《医疗器械生产质量管理规范》 第四章是设备,总共5条,主要要求企业配备与所生产产品和生产规模相匹配的生产设备、工艺装备、检验仪器和设备;设备应符合预定用途、便于操作、清洁和维护并有明显状态标识;仪器设备应有使用、清洁、维护和维修的操作规程,并保存相应的操作记录;配备满足使用要求的计量器具,定期进行校准并保存相应记录。设备的管理难点在于设备种类较多,如无法清晰准确对设备进行分类分级管理,眉毛胡子一把抓,会导至相关的文件和记录系统庞大,引起使用和记录人员的疑惑,为什么简单设备还要管理这么复杂,意义在哪里,觉得设备相关的文件和记录是无增效,纯负担工作,最终流于形式,那么就很难控制重要设备的使用性能和使用寿命,最终影响产品质量。只有根据产品生产工艺和生产过程,分析判断哪些设备对产品质量影响关键,并且性能参数发生偏移时无法察觉,将这类设备作为关键设备进行重点监控,实实在在做好设备的使用记录、维护保养、定期验证或确定,才能保证设备稳定可靠,生产的产品质量相对可控。对于计量器具的管理,可借鉴参考《GB∕T 19022-2003 测量管理体系-测量过程和测量设备的要求》。2.法规依据《医疗器械生产质量管理规范》第四章的设备内容如下图,比较简洁,无菌医疗器械及体外诊断试剂的生产质量管理规范附录增加了较多的特殊要求。无菌和IVD相同的特殊要求是空气净化系统需确认,停机后再次开启应进行必要测试或验证;工艺用水设备应能防污染,工艺用水满足产品质量要求,具备工艺用水管理文件;与物料或产品直接接触的设备、容器具及管道表面应能防污染。
2.2《医疗器械生产质量管理规范附录 无菌医疗器械》中设备相关条款
2.3《医疗器械生产质量管理规范附录 体外诊断试剂》中设备相关条款
2.4 美国FDA CFR 820对设备的管理要求在第G部分的产品和过程控制章节,具体规定位于 820.70–产品和过程控制, 820.72 –检查、测量、测试设备。

2.5《GB/T 42061-2022/ISO 13485:2016 医疗器械质量管理体系 用于法规的要求》要求生产设备、环境控制设备、监视测量设备做好维护活动,建立维护相关文件,并保留维护记录。监视测量设备的要求与FDA820.72一致,描述有些差异。

3.常见机构与人员不符合项汇总分析国家局2016-2022年飞行检查中关于设备的不符合项,可以看出关于设备管理的不符合项的数量占比较多的,位于生产管理、质量控制、厂房与设施之后。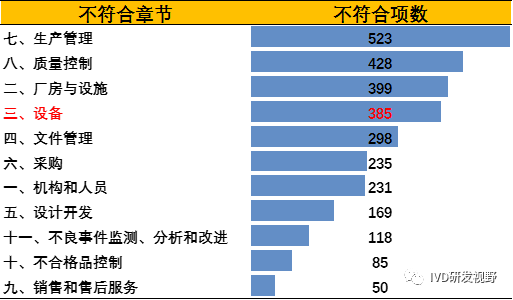
设备不符合项主要集中在计量器具、生产检验设备、净化系统和水系统的管理上,各类设备不符合情况分布见下图。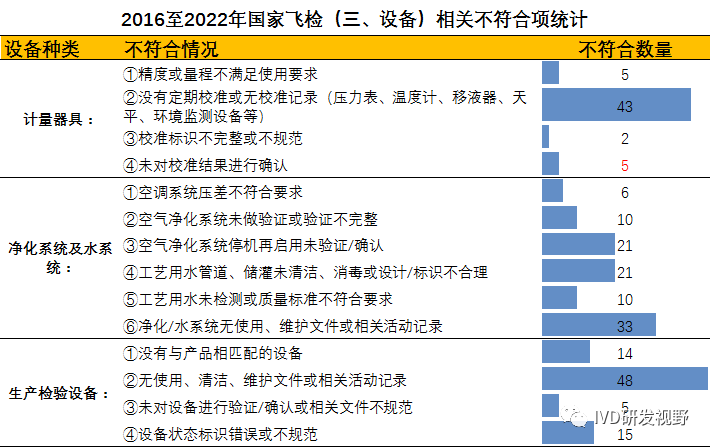



4.结语
|
声明:
1、凡本网注明“来源:小桔灯网”的所有作品,均为本网合法拥有版权或有权使用的作品,转载需联系授权。
2、凡本网注明“来源:XXX(非小桔灯网)”的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。其版权归原作者所有,如有侵权请联系删除。
3、所有再转载者需自行获得原作者授权并注明来源。
 /3
/3 