今天分享的话题是:单分子检测;免疫分析;数字免疫分析;微流控单分子检测
前言
精准医疗自提出以来就被认为是第三次医学革命和现代医学的发展方向,其核心由精准诊断和精准治疗构成。精准诊断是精准治疗的前提和基础,也是精准医疗的技术支撑和重要保障 。血液中蛋白质含量的精准测量技术是实现精准诊断不可或缺的重要手段之一。蛋白质生物标志物是疾病发生、发展过程中表达量发生变化的生物分子, 对疾病的早期诊断和预防起着重要的作用。目前, 免疫分析是临床上广泛使用的蛋白质检测方法,能够在短时间内准确检测特定抗原或抗体分子,在肿瘤标志物检测、预后监测、药物分析等领域已被广泛使用。
1. 研究背景
免疫分析是一种化学测量方法,利用抗原与抗体之间的特异性反应识别待测分子,进而利用试剂使识别出的待测分子产生信号进行定量分析。待测分子可以是抗原,也可以是抗体。免疫分析最早由美国科学家 Berson 和 Yalow发明 ,1977 年 Yalow 因此获得诺贝尔医学奖。到目前为止,免疫分析经过 50 多年的发展,分析模式多种多样,分析类型层出不穷,而且仍有新的方法不断产生。传统的免疫分析通过测量待测样品宏观信号的强度变化与目标分子浓度的关系进行定量,这类方法灵敏度普遍不高,检测限一般在 10-9~10-12mol/L。虽然对于已经发生明显症状的疾病诊断十分有效,但难以满足重大疾病早筛、神经障碍早诊、心血管疾病早检等需求。在重大疾病的早期阶段,血液中抗 原浓度在 10-15mol/L 级别甚至更低,常规免疫分析 根本测量不到,更不必说精准测量。比如前列腺癌术后患者的前列腺特异抗原(PSA)质量浓度为 0. 1~100×10-12g·mL-1,这样的低浓度都是传统免疫分析技术难以企及的范围。
单分子检测是在单分子水平上通过生物分子的构象变化、动力学、分子之间相互作用以及对单个分子进行操纵等方式进行检测,是一种适用于单分子水平上探求分子的基本物理和化学原理的独特技术,它提供了宏观测量无法实现的卓越灵敏度和高分辨率。早期主要应用于生物物理学的大分子结构变化研究和分析化学的毛细管电泳分离检测中,后来逐渐发展为单分子传感。单分子检测与免疫分析相结合产生了单分子免疫分析。
2. 单分子计数免疫的实现步骤
单分子计数免疫是一种以计量免疫复合体分 子个数进行定量免疫分析的技术,也就是以逐个分 子计数的方式统计免疫复合体的数量。
单分子计数免疫分析也称为数字免疫分析,其主要特征就是灵敏度极高,检测限至少是常规免疫分析技术的 1/1000,可以达到单分子检测水平 。单分子计数免疫分析能够满足肿瘤早期检测、血液中稀少抗原检测等高灵敏检测的需 求,是近些年免疫分析的前沿技术,被认为是下一 代免疫技术。
单分子计数免疫分析按照操作过程可以分为 4 个主要单元操作,即形成免疫复合体、离散、识别和计数。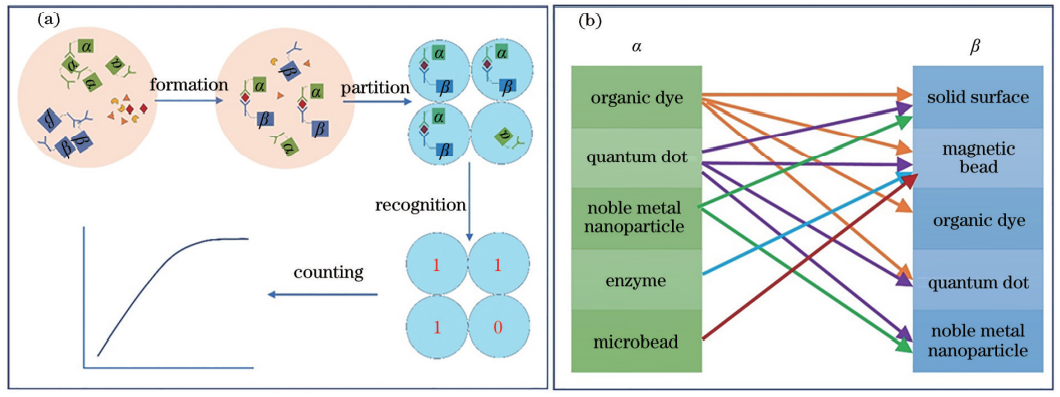
图 1 数字免疫分析。(a)一般流程;(b)偶联标记分类组合
形成免疫复合体是捕获目标抗原的过程,捕获 效率的高低决定了形成免疫复合体的数量,与所开发方法的检测限高低密切相关。目前看来,单分子计数免疫分析形成的免疫复合体均为三明治夹心结构,即捕获抗体-抗原-检测抗体形式。在捕获抗 体和检测抗体一方和双方上均可以偶联所需要的功能标签,如图 1(b)中的 α 和 β。比如需要检测功 能,则在检测抗体上连接荧光标签,α 可以是染料、 量子点、酶等;需要分离功能,则在捕获抗体上偶联磁珠标签,β 可以是磁珠、界面等。图 1(b)中 α 和 β 之间的连接线代表已经报道过的偶联方式组合。
离散是将免疫复合体分子在空间或时间上形成可区分、可计数、可统计的分散状态,是数字免疫分析的关键技术。离散分为硬离散和软离散两大类:硬离散是指利用相界面隔离的微空间将目标分子分散成单个分子的技术,主要包括微孔阵列离散和液滴离散。在硬离散条件下,分子与分子之间由两相界面隔离;软离散是在没有实体微空间情况下目标分子形成了不重叠的分散状态,分子与分子之间是连续相,分为时间离散和空间离散。硬离散起到浓缩效应和分离效应。对于 10-15mol/L 浓度的样品,如果将单个分子离散到 10 μL 尺度的液滴中, 在这个微空间中,样品浓度为 10-12mol/L 范围,检测难度大大降低。基质分子被离散到微空间中,使得每个微空间中的基质分子总量减少,样品分子与基质分子的比值增大,降低基质噪声,提高检测效果。软离散方法相对简单,但缺乏可控性,大多数空间软离散面临着进样的免疫复合体不能全部沉 积离散的问题。
识别是指利用光、电、磁学等方法,将目标分子产生的信号与背景和干扰分子的信号进行区分检测。理想的识别方法既能从干扰物质和游离探针中准确地识别出免疫复合体,又能识别出特异性结合和非特异性结合。
计数是数字免疫分析的定量方式,避免了宏观信号的波动带来的误差。定量准确度和定量方式受到抗原捕获效率、免疫复合体离散封装效率、识别效率的影响。当离散封装效率达到 100% 时,若阳性区间中不可区分单个免疫复合体,利用泊松分布阴性比率可以绝对定量;若可区分,则可以统计免疫复合体个数。当离散封装效率不能达到 100% 时,通过利用阳性区间中免疫复合体个数建立标准曲线进行定量。
3. 定量方法
单分子计数免疫分析中主要有两种定量方式:一是绝对定量,基于泊松分布概率函数计算浓度;二是计数定量,预先构建标准曲线,计量免疫复合 体的个数进行定量。
3.1 绝对定量
绝对定量不需要标准曲线,直接通过泊松分布公式计算而得,只要统计出阴性离散空间的比例即可,方法简单,适用于待测量的目标分子全部参与离散且被检测,也就是离散效率必须为 100%。然而大多数离散方法无法达到这一效率。微孔阵列离散过程中,大约 50% 的磁珠进入微孔,未进入微孔的磁珠被清洗去除,离散效率为 50% 左右。软离 散中样品分子沉积到基底的效率等同于离散效率, 与基底性质和采用的沉积方法有关,也难以做到 100% 沉积。液滴离散是能够做到完全离散的方法之一,数字液滴聚合酶链式反应(PCR)就是采用泊 松分布概率计算的绝对定量方法。
泊松分布定量方法如下:数字免疫分析的离散过程是将 m 个样品分子分装到 n 个微空间的过程。每个微空间中的平均分子个数(λ)与样品浓度(C)和微空间个数(n)相关。λ 是未知量,只要估计出 λ 就可以计算出样品浓度。
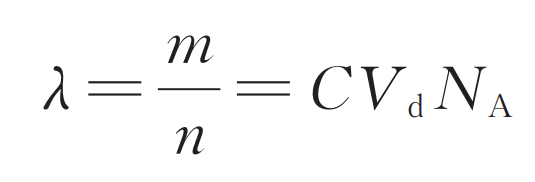
式中:Vd为微空间的体积;NA为阿伏加德罗常数。
3.2 计数定量
泊松分布计算定量的方式不需要标准曲线,简单易行,然而要求所有待测目标分子皆参与离散。这个条件并不容易满足,只有在用液滴离散和软离散蒸干的时候才能满足。大部分情况下,离散效率达不到100%。这时,可采用阳性粒子计数的方式定量。这也是大多数单分子计数免疫采用的定量方式,包括微孔阵列离散的数字免疫。在微孔阵列硬离散免疫中,绘制标准曲线和测量未知浓度时,测量结果的分析流程如下:
第一步 :测量出不同浓度标准样品阳性微孔总数;
第二步:各浓度下微孔总数减去背景假阳性微孔数;
第三步:计算阳性微孔比例:P(active);
第四步:计算阴性微孔概率:1-P(inactive);
第五步:根据泊松分布公式计算每个磁珠上酶分子个数 λ;
第六步:横坐标为浓度,纵坐标为每个磁珠上酶分子个数 λ,绘制标准曲线。软离散免疫分析时,在鉴定检测信号(阳性信号)来自单个免疫复合物后,直接统计不同浓度下的阳性信号数,即可绘制标准曲线[1]。
4. 市场应用方向
单分子免疫检测模式可分两类: 原位检测和随机分配检测。原位检测即免疫复合物的形成和检测在提前设定的固定区域内完成,采用高敏感型的检测设备对信号进行读取,如基于电传感器、超高分辨率近场扫描显微镜及等离子纳米孔的检测方式,但该检测方式因所用仪器昂贵,信号易受干扰及对操作者要求较高,目前较难实现临床应用。
随机分配检测,即在进行信号检测时将免疫复合物随机分配到设定的检测区域,该检测区域所包括的体积多在 nL 以下,以提高局部浓度,提升检测灵敏度。基于微阵列芯片和微液滴的单分子免疫检测均属于随机分配方式,且前者目前已实现自动化及商业化[2]。
4.1 基于微阵列技术的单分子免疫检测
微阵列是目前单分子免疫检测应用最广泛的一种方式,其在毫米级的芯片上雕刻或浇筑成千上万个微米级微井,微井体积多在 40 fL 左右。通过将捕获有免疫复合物的磁珠分配至单个微井中,再利用高分辨率荧光显微镜对荧光点进行计数。由于基于磁珠的全自动化检测发展成熟,因此只需增加磁珠分配和信号读取模 块,便可实现单分子免疫检测的全自动化。Quantarix 公司的 SimoA 是目前最具代表性的基于微阵列技术的单分子免疫检测。
Simoa技术原理:Simoa检测的生物学原理是经典的免疫反应-双抗夹心法,所不同的是,Simoa技术将约250,000个捕获抗体包被在2.7μm的小磁珠上,检测时加入生物素标记的检测抗体及亲和素偶联的酶和底物,通过一层油将单个磁珠分别封闭在238,000个4.5μm的反应孔(Well)中进行反应。由于每个小孔的反应体系仅仅为50飞升,比传统ELISA小20亿倍,这时小孔中即使只有一个分子,其催化底物就可产生3000个荧光分子,通过CCD摄像头即可捕获到信号,利用泊松分布理论可计算出阳性荧光小孔(OnWell)对应的蛋白浓度值,实现数字化单分子检测。
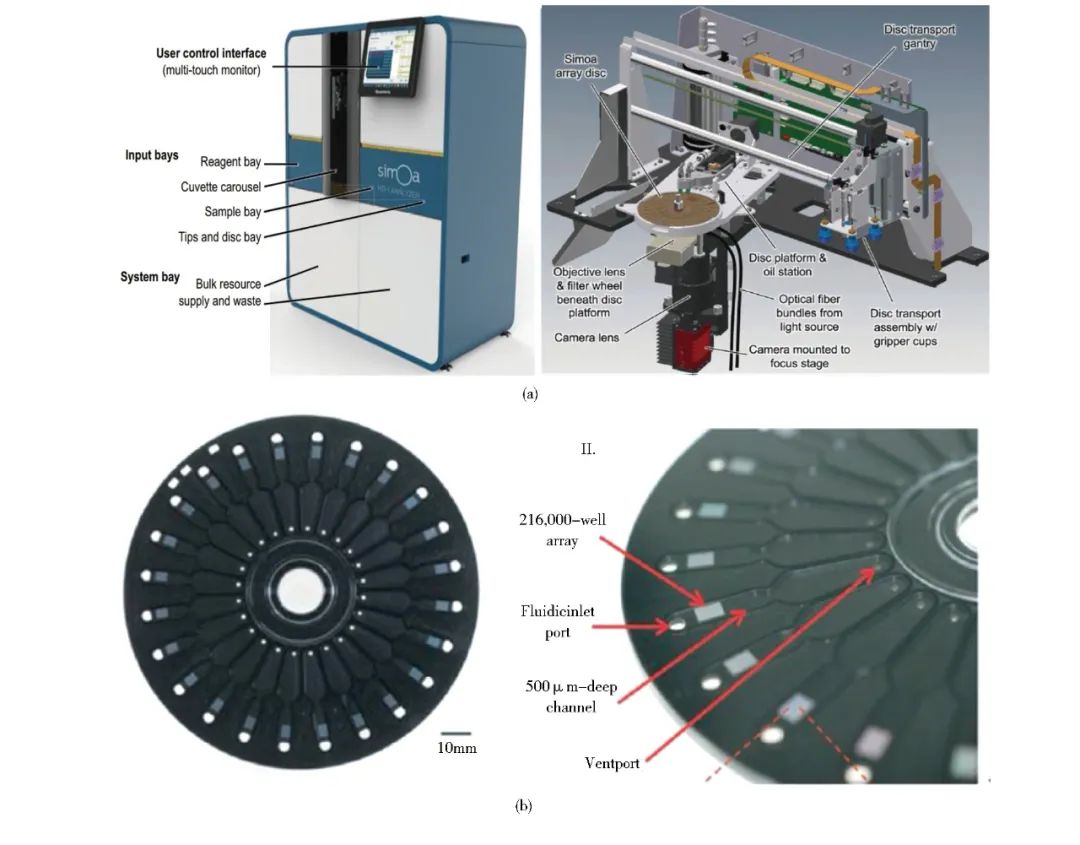
图2:HD-1 分析仪。(a) HD-1分析仪的仪器图片和内部结构;(b)与HD-1分析仪匹配的真实芯片
2012 年,Kan 等基于环孔聚合物研发出具有 216 000 个微孔的芯片 ( 图1a) ,每孔体积 50 fL 左右,且将 24 个这样的芯片整合至一张 DVD 式圆盘上( 图2b) ,同时添加微流道和进出口,实现了检测的高通量及自动化,这是单分子免疫检测从实验室到临床应用的一大飞跃。目前该 DVD 式圆盘芯片已实现量产并应用于 Quanterix 公司的 SimoA HD-1 分析仪,图2a。与普通化学发光法或 Elisa 法相比,可将检测灵敏度提高 2 ~ 3 个数量级。Quanterix 公司将全自动检测仪器 HD-1进入市场并开始应用,该仪器可在一小时内完成 66份样本检测,且可平行测定10种不同靶标,目前已成为数字免疫检测的金标准。
4.2 基于微液滴技术的单分子免疫检测(微流控芯片)
虽然基于微阵列技术的单分子免疫检测已实现自动化,但受限于仪器规格,无法应用于床旁检测( point-of-care testing,POCT) 。而微流控技术为开发 POCT 版的单分子免疫检测( 图 4) 提供了理论和技术基础。通过特殊设计的微流道,利用流动剪切力和表面张力,将连续流动相分割在极小体积的液滴里( nL 以下) ,常见液滴形式为油包水和水包油。
微液滴生成方式分为主动式和被动式。主动式微液滴的生成需借助于电力、磁力和离心力,其优势在于:( 1) 能够实时控制液滴生成速率和大小;( 2) 能够在毫秒内达到生成液滴的稳定状态。但由于需要整合精密原件和特殊仪器,目前主动式微液滴技术主要应用于实验室研究。被动式微液滴的生成主要依靠微流控芯片的流道设计,仅需蠕动泵便可生成尺寸均一的液滴,这是目前采用最广泛和实现应用的一种方式。被动式微液滴的生成方式包括 T 型通道法、共流聚焦法( co-flowing) 、流动聚焦法( flow focusing)。
其中流动聚焦法由于易操控,设计灵活,可根据目的增加分散相通道数量实现多种试剂预混,故目前的单分子免疫检测常基于此种方式生成微液滴。微液滴体积大小主要取决于芯片流道尺寸设计,现已设计出多种不同的芯片结构来生成 fL 级别的微液滴。
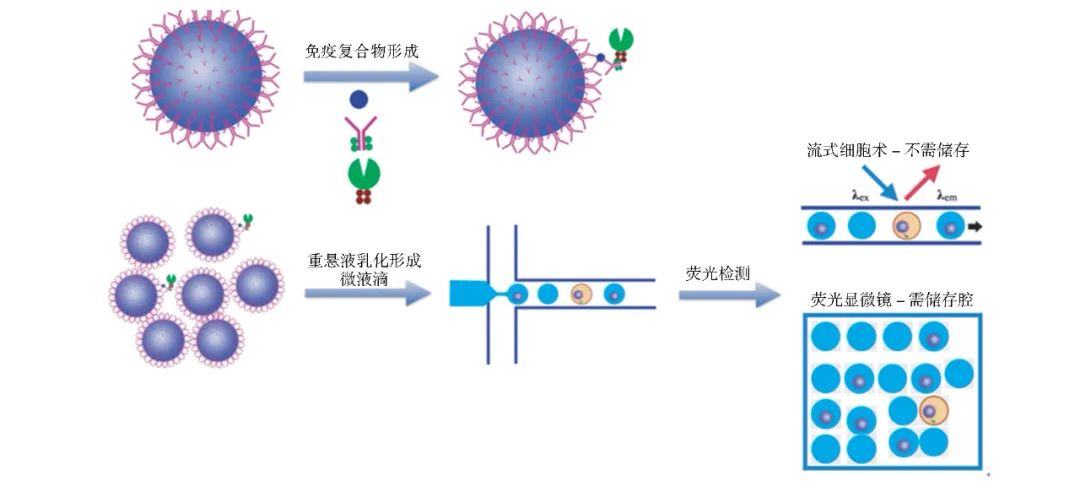
图3:微液滴单分子免疫检测原理图
实现基于微液滴的 POCT 检测需要在短时间内生成( > 104/ s) 并检测( > 105/ s) 大量液滴。Yelleswarapu等研发的超量微液滴检测器 ( μMD) ( 图 3) ,通过整合 100 个微液滴生成器,可在 10 min 内生成 107个液滴;利用时域编码的手机成像技术,可在 1 秒钟内检测106个液滴。同时,在芯片上游整合磁珠孵育器,实现了检测一体化。该团队还利用两种不同荧光染料标记的磁珠,对 IL-6 和 GM-CSF 进行平行检测,检测下限可达 300 amol /L,完成了一款性能可与 SimoA 媲美的双重POCT 检测仪器,整个仪器制作费用仅约 500 美元[3]。
基于微阵列芯片和微液滴的单分子免疫检测技术的检测灵敏度均可达到 10-18mol / L,二者各具优势和不足( 表 1) 。微阵列技术已经实现全自动检测和商业化,但其成本较高,难以实现床旁检测,而微液滴技术更适合床旁检测,但芯片制作工艺尚不成熟,有待进一步发展。

图4 微阵列与微流控技术比较
5. 总结
综上所述,单分子免疫检测已经取得阶段性进展,相比现有检测手段,分析灵敏度提高至少三个数量级,达到 zmol /L,为痕量标志物的发现及其临床意义的研究提供了新的手段。单分子免疫检测在神经性疾病、感染性疾病和肿瘤检测方面表现出一定优势: ( 1) 使血液、唾液、尿液替代其他不易采集的标本; ( 2) 对已有标志物进行临床意义的再发现; ( 3) 对疾病的早期干预和治疗。
目前,尽管 SimoA 技术已经成功实现了商业化,具有自动化、高通量的优势,但其应用仍主要集中于实验室基础研究,在临床中的应用十分有限。SimoA 技术受限于临床应用主要有以下几方面的因素:首先,目前已经发现的痕量标志物仍较为有限,且其临床意义尚未完全阐明;其次,相比现有化学发光检测,SimoA 单分子免疫检测耗时较长,且为批量检测,无法实现标本的随到随检;第三,单分子免疫检测仪器和耗材均较为昂贵,这在一定程度上限制了其推广和使用。因此,发现更多的痕量标志物并阐明其临床意义,基于成本低、操作简便、适合 POCT 检测的微液滴等技术研制更加高效、成熟的单分子免疫检测平台,将有助于推动单分子免疫检测技术的临床应用,从而为疾病的诊断和预后提供新的手段。
[1]苏玉婷,盖宏伟.单分子计数免疫分析[J].激光与光电子学进展,2022,59(06):174-196.[2]张雪洁,汤家宝,李廷栋,葛胜祥.单分子免疫检测技术研究进展[J].中国生物工程杂志,2021,41(04):47-54.DOI:10.13523/j.cb.2101006.[3]Yelleswarapu V, Buser J R, Haber M, et al. Mobile platform for rapid sub–picogram-per-milliliter, multiplexed, digital droplet detection of proteins[J]. Proceedings of the National Academy of Sciences, 2019, 116(10): 4489-4495.
 /3
/3 