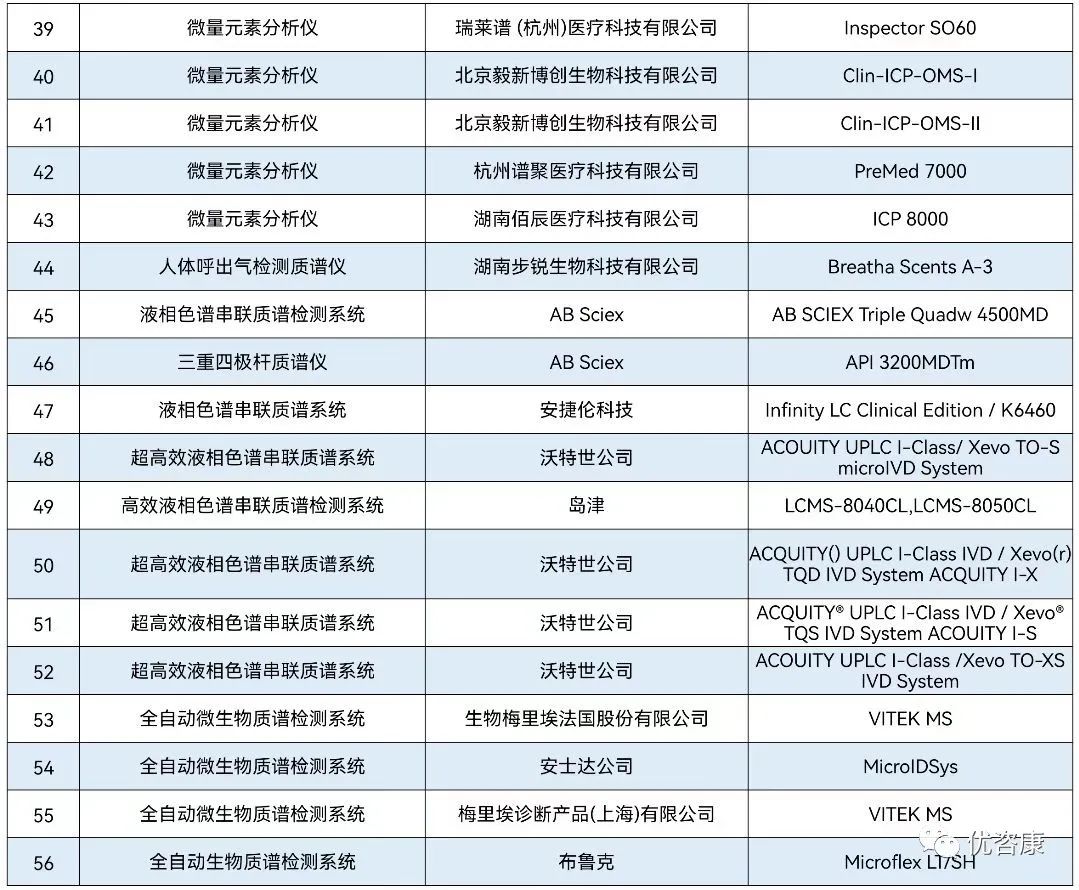
| 临床质谱,是指针对临床上特定分子的检测需求,结合了质谱仪器、试剂、耗材及样本前处理的一整套解决方案的统称。作为新兴的临床检验技术代表之一,质谱技术因其快速、准确、特异性高等优点,逐渐由科研走向临床诊断。质谱作为高精尖技术,在临床检验中的应用也越来越广泛和深入,如维生素检测、新生儿遗传代谢病筛查、TDM血药监测、固醇类激素检测以及代谢组学和蛋白组学研究等,主要技术平台包括液相色谱串联质谱(LC-MS/MS)、基质辅助激光解吸飞行时间质谱(MALDI-TOF MS)、电感耦合等离子体质谱(ICP-MS)等。而在2023年1月5日和3月8日,接连获证两款核酸质谱试剂盒,核酸与质谱的结合也逐渐步入大家的视野。下面小编将对已上市质谱仪器设备、核酸质谱试剂以及2022年进入临床试验的质谱项目进行详细分析。 截至目前,国内获得NMPA注册证的质谱设备共56个,涉及45家公司, 8家国外企业,37家国内企业。其中液相色谱-串联质谱仪27个,飞行时间质谱仪22个,电感耦合等离子体质谱仪6个和气相色谱质谱仪1个,见图1。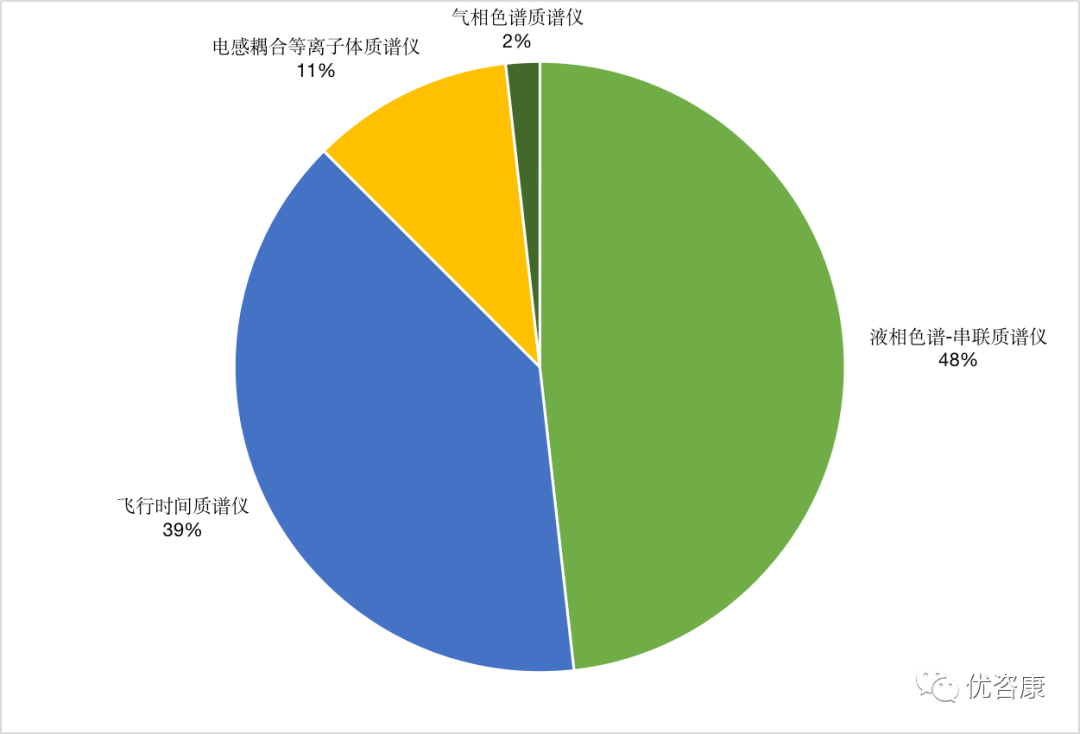 质谱仪器设备具体信息如下: 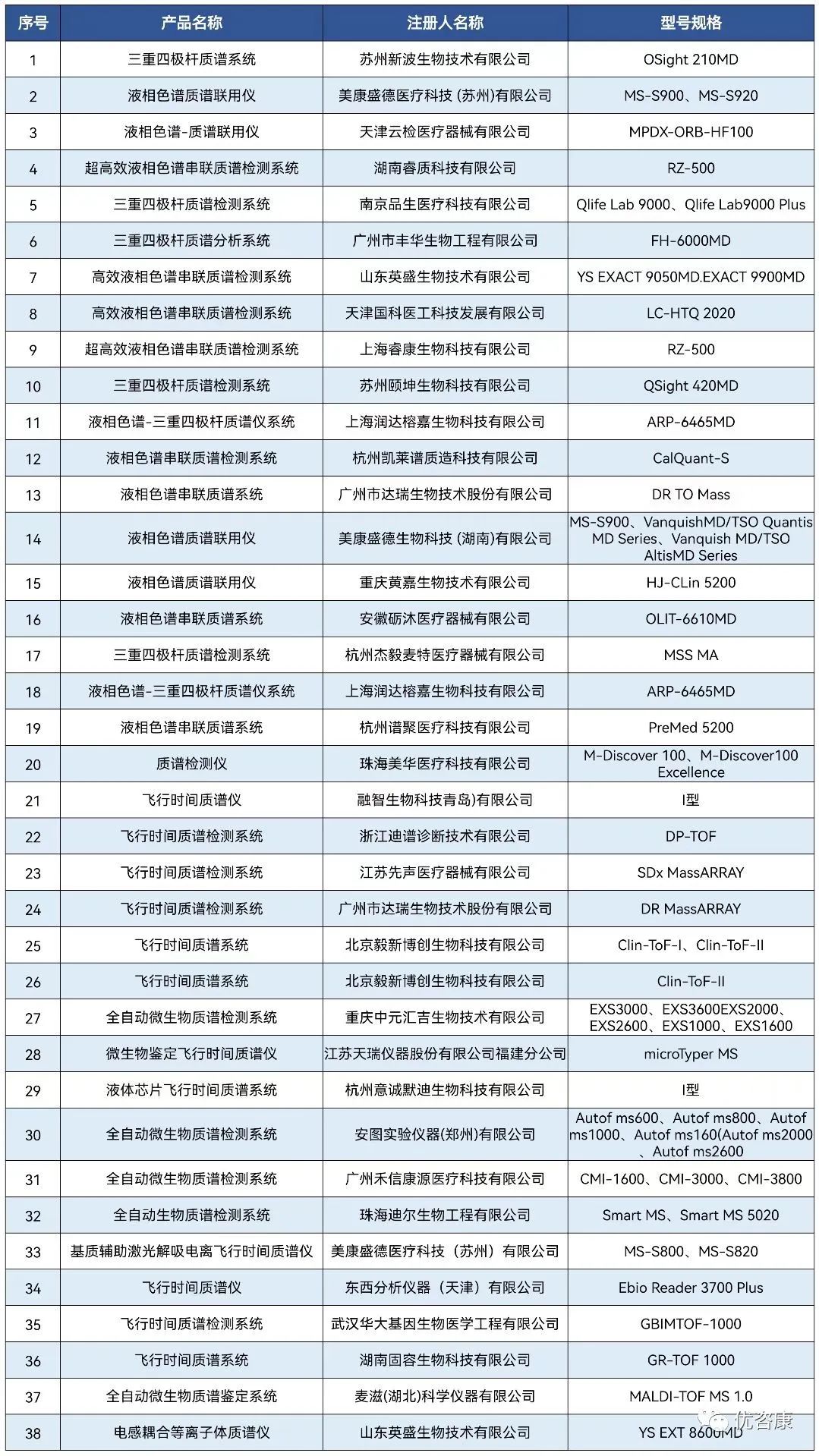
基于质谱的核酸测序试剂是一种新型的核酸测序技术,它采用质谱技术对DNA、RNA等核酸分子进行测量,可以高效地实现高通量测序。核酸质谱作为一种新兴的基因检测方法,具有多位点、高通量、低成本、周期快的差异化优势,将是继NGS 之后,继续推动中国精准医疗快速发展的重要力量,加速实现基于多基因位点检测的临床分子诊断及精准医疗。
2023年1月5日,国家药品监督管理局(NMPA)正式批准注册由达安基因控股子公司达瑞生物研发生产的“二十项遗传性耳聋基因突变检测试剂盒(飞行时间质谱法)”,该试剂盒是国内首个基于飞行时间质谱技术进行耳聋基因检测的获证试剂盒,也是国内首个获得国家药监局批准的核酸质谱试剂盒。2023年3月8日,Agena公司与先声诊断共同推进的“人CYP2C19基因分型检测试剂盒(飞行时间质谱法)”正式获得国家药品监督管理局(NMPA)第三类医疗器械注册证,这也是国内首个基于飞行时间质谱技术进行药物基因组检测的获证试剂盒。该产品获批用于体外定性检测正在服用或将要服用氯吡格雷进行抗血小板治疗的冠心病和缺血性卒中患者外周血样本中CYP2C19基因的多态性,助力心脑血管疾病临床精准用药。是继今年1月达瑞生物的耳聋基因检测试剂盒获批后,基于MassARRAY®核酸质谱平台获批的国内第二张第三类医疗器械注册证。 基于质谱技术的新型检测方法和诊断试剂盒将加速推进临床应用的快速发展,在2022年共进行了3项临床试验,分别是:人EGFR/KRAS/BRAF/NRAS/ERBB2/PIK3CA基因突变检测试剂盒(飞行时间质谱法)临床试验、人循环肿瘤 DNA 多基因突变联合检测试剂盒(飞行时间质谱法)临床试验和人CYP2C19基因检测试剂盒(核酸质谱法)。可以将以上3项临床试验分为2类,前2项为治疗药物靶点检测相关试剂,第3项为人类基因检测相关试剂。具体数据如下:

截至目前,国内已有多家企业掌握了核酸质谱技术,包括华大基因、达安基因、贝瑞基因、迈瑞医疗、华大智造等。但目前国内核酸质谱市场仍处于初级阶段,市场分散,未形成龙头企业,处于爆发前夜,竞争格局尚未稳定,国内外几家主要的核酸质谱企业在竞争中互相促进,推动核酸质谱产业快速发展。 2022年11月7日,国家卫生健康委办公厅印发了《国家检验医学中心设备标准》将一些质谱项目列入必备检验项目清单。随着利好政策的逐步出台,这将大大推动质谱技术在临床应用方面的发展,未来核酸质谱将成为更多疾病的临床分子诊断新手段。
|  /3
/3 