缺席两年的流感又开始在美国和其他国家爆发了,这让很多欧美IVD企业松了一口气,因为新冠多联检市场将给他们带来新的业绩增长,同时多联检FDA批准需要的Flu B临床也可以开始了。在新冠疫情流行之前,流感病毒(Flu A 和Flu B)每年冬天都会导至数千万美国人患病,和数万人死亡。在2018-2019的冬季,流感导至1,300万人就诊,38万人住院,2. 8万人死亡。然而在过去两年中,因为新冠疫情促使人们广泛佩戴口罩、保持社交距离以及学校和日托中心的关闭,流感和患RSV的感染人数也跟着下降。随着全球躺平,各国的防范措施被放弃,流感季节又回来了,而且2022年流感季节来得更早了一些,据公共卫生专家预测将会比新冠疫情前更严重。下图是美国CDC最新统计的因流感而住院的人数,2022年流感季很显然要比以前早很多。
▲美国CDC统计每年累积的确诊流感占比(2021年的第40周是10月3日)
流感爆发的同时,美国的新冠疫情也没有好转,因为新的变异BQ.1.1、BQ.1和BF.7占比继续扩大,10月30日至11月5日,美国前三流行变异株为:BA.5(39.2%)、BQ.1.1(18.8%)和BQ.1(16.5%)。BA.5、BA.1.1、BQ.1、BF.4.6、BF.7等各种变异株同时流行。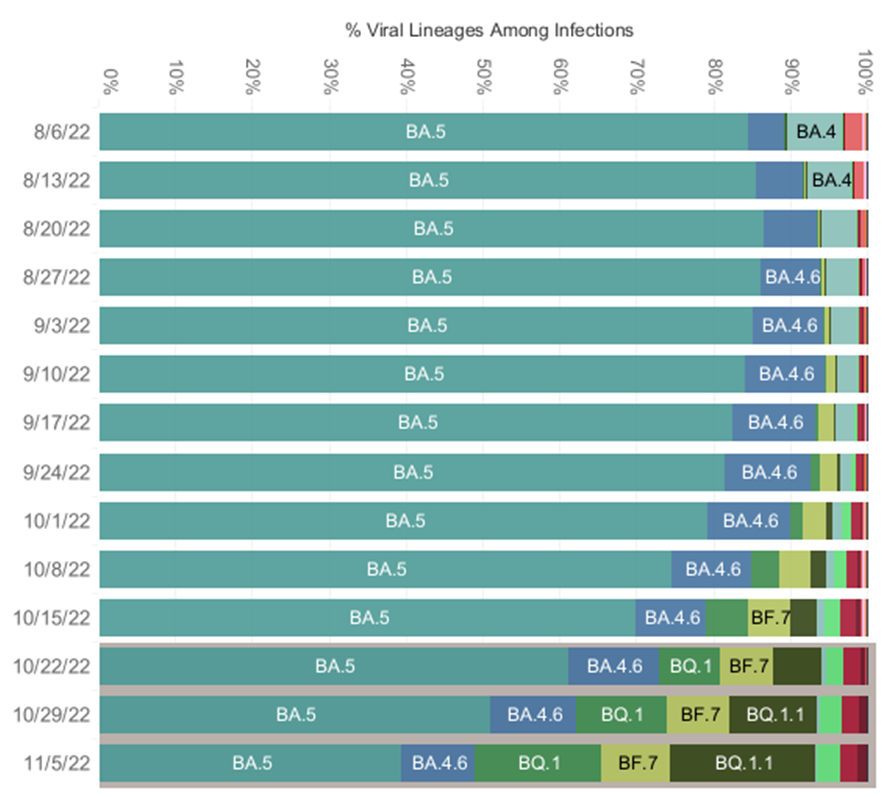
这些新的变异增加了新冠病毒的免疫逃逸能力,造成美国新增新冠患者数量最近还在增加,和其他国家不一样。根据美国CDC的统计数据,美国因为流感和新冠感染人数的叠合增加,使得因为呼吸道感染去医院进行就医的人数大增。

特别是受感染的儿童病情更严重,因为他们免疫力极度衰弱。这主要是因为很多孩童在新冠疫情之前没有接触过流感/RSV病毒,或者他们的免疫力出现减弱现象。
美国CDC指出,去年所有年龄组的流感疫苗接种率与前一年相比略有下降。6个月至4岁的高危儿童的疫苗接种率下降幅度最大,从新冠疫情前的75%降至67%。从CDC的数据也可以看出,孩童的流感感染占比在今年尤为突出,最近3周已经超过10%。
这对于有新冠多联检产品的IVD企业来说将是一个利好,未来新冠检测市场将是新冠+ Flu A+ Flu B多联检产品为主的市场,另外RSV和Strep
A检测也是有长期需求。
新冠多联检将取代单一的新冠检测试剂
早在去年7月,美国CDC就公布了在2021年底终止其单一新冠的RT-PCR试剂,换成可以检测新冠和Flu的多联检RT-PCR试剂。
美国最大的连锁实验室Quest Diagnostics在11月3日表示,正在美国扩大其检测流感和新冠的多联检检测的渠道,让患者可以在其1,600个检测中心自行采集样本进行新冠和流感的检测。
bioMérieux在其Q3的财报中表示其呼吸疾病诊断的需求上保持稳定,且强于预期。公司表明在流感季节之下,多联检的需求旺盛。
Cepheid的呼吸道疾病检测业务在Q3带来了约8.75亿美元的收入,大大超过了3.25亿美元的预期。Cepheid表示增长的原因是流感的流行率高于预期,以及消费者提前购买产品,来应对更糟糕的流感季节。因此这种预期导至消费者普遍偏爱Cepheid的四联检呼吸检测产品来测试SARS-CoV-2、Flu A 和Flu
B和RSV呼吸道合胞病毒。
最近自然杂志(Nature)的一篇由美国北卡罗利拉大学分子实验室主任Melissa Miller, Ph.D的文章指出,未来的检测市场将会有两种多联检产品,一种是只包含常见呼吸道病毒,新冠+flu A+fluB和RSV的小型多联检产品(mini
multiplexes),一种是包含20-30种以上呼吸道病毒的大型多联检产品(big mini
multiplexes)。

根据Miller博士,在新冠病毒之前不同呼吸道病毒的症状就非常类似,但是治疗方法完全不一样,因为新冠病毒的加入,治疗方法就更加复杂。如果不依靠多联检的检测结果,呼吸道病毒病人的治疗将会很复杂,在高发季节很容易造成医院资源的浪费。
FDA将鼓励新冠多联检的批准
自2020年7月CDC推出的新冠多联检PCR检测Influenza SARS-CoV-2 (Flu SC2) Multiplex Assay之后,目前拿到FDA EUA认证的多联检分子检测产品有9个:
1. Roche Diagnostics的cobas SARS-CoV-2 & Influenza A/B(最早获得FDA批准的商业新冠/流感多联检产品)
2. Cepheid的Xpert Xpress
SARS-CoV-2/Flu/RSV
3. Thermo Fisher的TaqPath COVID-19, FluA, FluB Combo Kit、
4. Quest Diagnostics的RC COVID-19+Flu
RT-PCR、
5. LabCorp的Labcorp
SARS-CoV-2 & Influenza A/B Assay、
6. Hologic的Aptima
SARS-CoV-2/Flu assay、
7. Applied BioCode的BioCode CoV-2 Flu Plus Assay、
8. Exact Sciences的COVID-Flu Multiplex Assay
9. NeuMoDx Molecular的NeuMoDx Flu A-B/RSV/SARS-CoV-2 Vantage Assay.
目前市场唯一获得FDA批准的大型新冠多联检产品是BioFire Diagnostics的Biofires Respiration panel ,2021年3月获得FDA De Novo的批准,该分子检测产品可以检测出22种呼吸道病原体,包括新冠病毒、流感A/B病毒及RSV病毒。
除了PCR多联检产品,FDA目前还批准3个POC的新冠抗原多联检产品:
1. Quidel的Sofia 2 Flu
+ SARS Antigen FIA
2. BD的Veritor
System for Rapid Detection of SARS-CoV-2 & Flu A+B
3. Princeton BioMeditech的Status COVID-19/Flu A&B这3个新冠抗原多联检产品都需要医生处方,并只能在诊所使用。
对于家用OTC的新冠抗原多联检产品,虽然FDA自2021年底就开放和鼓励IVD企业申请,目前FDA还没有一家批准的,主要挑战就是FDA对于OTC新冠抗原多联检产品的临床要求太高,特别是对于Flu B的要求,需要前瞻性的样本或者是冰冻的Flu B swab。
而在过去的两年中,美国几乎没有Flu B 病例。
突如其来的流感包括Flu B,让美国的IVD企业终于松了一口气,可以开始FDA新冠抗原多联检的临床了。
 /3
/3 