今日,美国FDA宣布,批准PerkinElmer公司开发的GSP血清肌酸激酶试剂盒上市,用于杜兴氏肌营养不良症(DMD)新生儿患者的筛查。该产品是FDA批准的首款适用于新生儿DMD筛查的试剂盒。

DMD是由于在X染色体上编码抗肌萎缩蛋白的基因上出现突变而导至的罕见遗传病。抗肌萎缩蛋白的缺失或缺陷,导至肌肉在收缩过程中出现慢性损伤,炎症发作,影响肌肉的再生。最终,肌肉被瘢痕组织或者脂肪代替。患者的肌无力症状在2-3岁时就很明显,随着肌肉组织和功能的不断丢失,在12岁时通常只能靠轮椅行动,20岁时需要辅助呼吸,在30-40岁时因为呼吸或心力衰竭而早夭。早期筛查可防止不必要的危险发生,并允许适当的早期干预和临床监测。
肌酸激酶(CK)是存在于肌肉细胞中的一种酶,在肌肉受损时则会流入到血液中。CK有几种不同的亚型,其中CK-MM亚型主要存在于骨骼肌细胞中,影响骨骼肌的损伤。DMD患者CK-MM酶的水平通常很高,因此CK酶水平的测量被用于DMD患者诊断的标准临床化学测试。GSP肌酸激酶试剂盒则是通过测量CK-MM酶的水平来鉴定新生儿是否携带致病基因。该试剂盒适用于PerkinElmer公司的GSP自动化生化分析仪器。
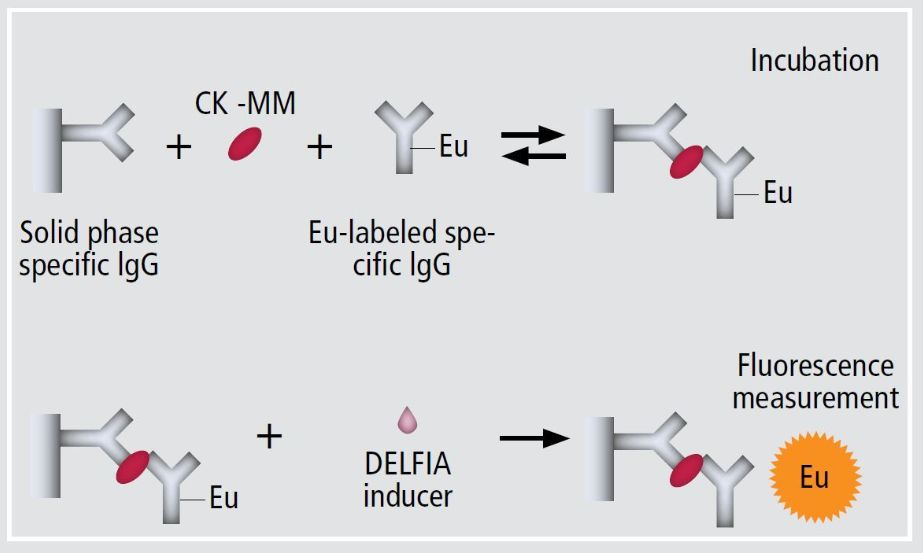
▲DMD筛查试剂盒原理示意图(图片来源:PerkinElmer官网)
该试剂盒的批准是基于3041名新生儿的临床检测数据。通过对新生儿血液样本中DMD相关CK-MM蛋白质水平的评估,该试剂将4名携带DMD致病基因的新生儿准确地鉴定出来。此外,PerkinElmer公司也对30名已确诊为DMD患者的新生儿进行了测试,结果表明,所有患病新生儿均被鉴定为DMD患者。
“安全有效的筛查新生儿疾病,可以帮助卫生保健人员在婴儿发生症状,或在疾病对婴儿健康的影响变得明显之前,与其父母和看护人讨论并确定潜在的治疗选择,”FDA医疗器械和放射健康中心的体外诊断和放射健康办公室主任Tim Stenzel博士说:“该产品的批准显示了我们致力于促进医疗设备创新的承诺,以帮助患者和护理人员提供更好的治疗选择。”参考资料: [1] FDA authorizes first test to aid in newborn screening for Duchenne Muscular Dystrophy, Retrieved December 12, 2019, from https://www.fda.gov/news-events/press-announcements/fda-authorizes-first-test-aid-newborn-screening-duchenne-muscular-dystrophy
[2] GSP Neonatal Creatine Kinase-MM kit, brochure, Retrieved December 12, 2019, from https://newbornscreening.perkinelmer.com/files/607/GSP_Neonatal_Creatine_Kinase-MM_assay_Brochure_17.1.2018_1599-9824.pdf |  /3
/3 