
以血液为主的液态活检面对的核心问题之一是血液中肿瘤相关cfDNA的检测结果能否作为肿瘤组织的客观反映,两者的吻合度如何?虽然肿瘤的组织样品对于突变位点的分析是合适的,但也存在一些瓶颈:并非所有的肿瘤都能通过手术获得病灶;即使能够获得组织样品,其DNA的含量与质量也常常会影响分子检测的结果;最大的难点在于肿瘤组织的异质性。异质性又可以分为空间上的和时间上的,前者的异质性存在于病灶的不同部位或者原发灶与转移灶之间,后者的异质性存在于肿瘤发展与治疗的不同阶段。
以血液内cfDNA为检测对象的液态活检就能很好的解决上述难点:样品的收集是无创或微创的;可以随时采样,做到病灶相关biomarker的实时掌握,解决了肿瘤时间维度上的异质性;血液内的cfDNA能综合地反映肿瘤整体情况,排除空间上的异质性。
虽然液态活检的概念很好,但也有先天的限制:cfDNA高度的片段化,其长度最长一般不超过180bp;突变的DNA占总的cfDNA比例超低,现有检测手段的灵敏度往往不够,之前一些研究的结果表明与组织活检相比,液态活检的灵敏度在43%~66%之间。
文章以86个临床上确认的晚期NSCLC病人(没有接受过TKIs治疗)进行对照研究,检测位点是EGFR的L858R和Exon 19缺失。其中组织样品采用经过CFDA认证的ARMS试剂盒进行检测,血液样品中cfDNA采用微滴式数字PCR(ddPCR)检测,ddPCR的实验设计方案如下图。 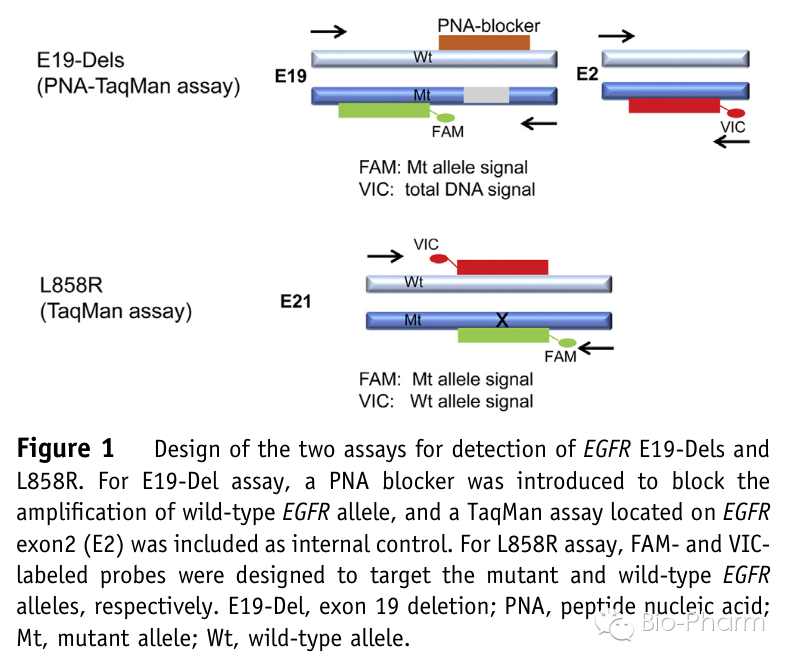
首先作者采用E19-Dels和L858R的阳性细胞系作为对照测试了ddPCR体系的灵敏度。上述2个ddPCR体系的检测灵敏度都可达到0.04%(1:2500) 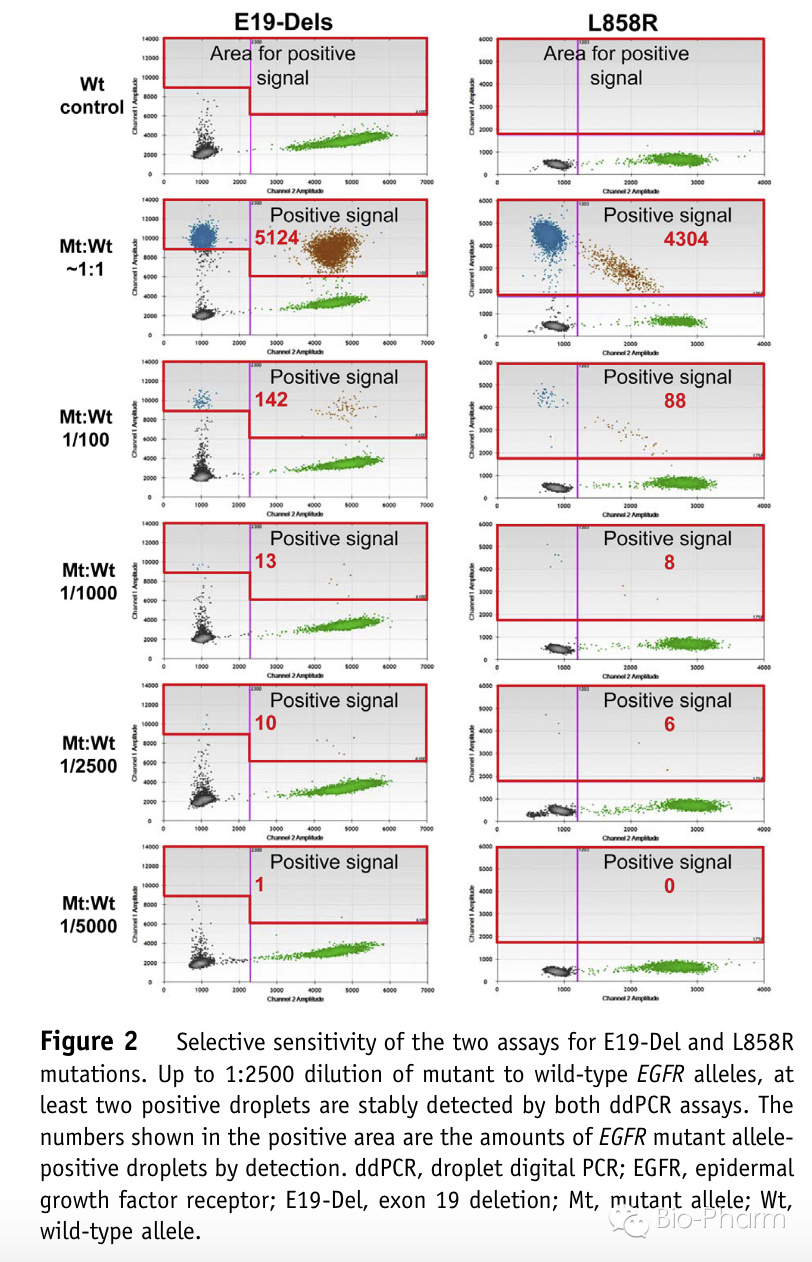
86个病人组织活检和血液中cfDNA的检测如下图。对于E19-Dels,液态活检相比于组织活检灵敏度为81.82%,特异性为98.44%,一致性为94.19%;对于L858R,液态活检相比于组织活检灵敏度为80.00%,特异性为95.77%,一致性为93.02%。由于采用了灵敏度更高的ddPCR技术,把液态活检的灵敏度提高到了大于80%的水平。至此,文章回答了开头的核心问题:在ddPCR技术平台和合理的assay设计及优化条件下,液态活检的结果和组织活检结果具有良好的一致性。
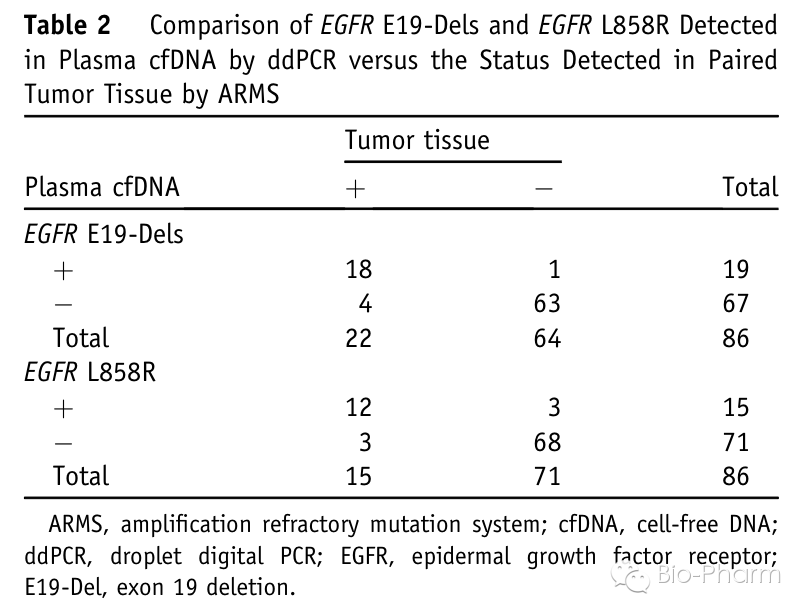
接着文章对血液和组织检测结果不一致的样品进行了分析。其中液态活检相比组织活检多发现了4个阳性病人,其中1人为E19-Dels阳性,突变含量为0.29%,3人为L858R阳性,突变含量分别为0.29%,0.80%和1.61%,分别为下图中的样品3、4、7和11。造成不一致的原因有可能是在组织活检中,由于肿瘤组织的异质性导至了漏检。
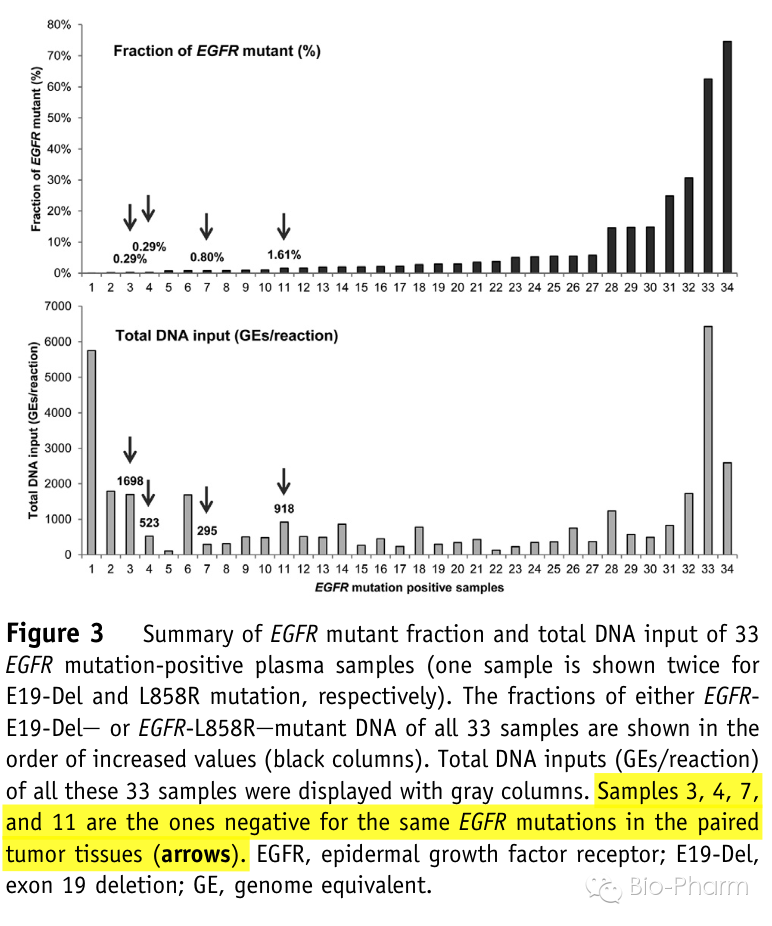
同时液态活检相比组织活检在6个突变阳性病人中没有检出突变,作者分析的原因有二:这6个病人血液中本身cfDNA含量非常低,每个反应中的GEs为204-954,即使存在突变位点其含量也远低于assay的检测灵敏度;其中5名病人在采血前都接受了一段时间的化疗,而化疗会降低对应突变在血浆中的含量。(Frank Chen)
Highly Sensitive DropletDigital PCR Method for Detection of EGFR-Activating Mutations in PlasmaCelleFree DNA from Patients with Advanced NoneSmall Cell Lung Cancer Guanshan Zhu,* Xin Ye,* Zhengwei Dong,* YaChao Lu,* Yun Sun,*Yi Liu,y Rose McCormack,z Yi Gu,* and XiaoqingLiu Epidermalgrowth factor receptor (EGFR) mutation testing in plasma cell-free DNA fromlung cancer patients is an emerging clinical tool. However, compared withtissue testing, the sensitivity of plasma testing is not yet satisfactorybecause of the highly fragmented nature of plasma cell-free DNA, low fractionof tumor DNA, and limitations of available detection technologies. We thereforedeveloped a highly sensitive and specific droplet digital PCR method for plasmaEGFR mutation (exon19 deletions and L858R) testing. Plasma from 86 EGFR-tyrosinekinase inhibitor-naive lung cancer patients was tested and compared with EGFRmutation status of matched tumor tissues tested by amplification refractorymutation system. By using EGFR mutation-positive cell DNA, we optimized thedroplet digital PCR assays to reach 0.04% sensitivity. The plasma testingsensitivity and specificity, compared with the matched tumor tissues tested byamplification refractory mutation system, were 81.82% (95% CI, 59.72%–94.81%) and 98.44% (95% CI, 91.60%–99.96%),respectively, for exon19 deletions, with 94.19% concordance rate (κ = 0.840;95% CI, 0.704–0.976; P < 0.0001), whereas they were80.00% (95% CI, 51.91%–95.67%) and 95.77% (95% CI, 88.14%–99.12%), respectively, for L858R, with 93.02% concordance rate (κ = 0.758;95% CI, 0.571–0.945; P < 0.0001). The reported highlysensitive and specific droplet digital PCR assays for EGFR mutation detectionhave potential in clinical blood testing. Supported by AstraZeneca. 
来源:Bio-Pharm
|  /3
/3 