金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
▉ 导语
最近,大家的朋友圈想必都被一个震撼性消息刷屏了。美国Colossal公司宣布,他们利用基因编辑技术,成功“复活”了已灭绝的史前物种——恐狼(Dire Wolf)。这一尝试再次将物种复活计划的生态影响、伦理合理性等复杂议题推到了聚光灯下。曾创造出“世界首例免疫艾滋病的基因编辑婴儿”的前南方科技大学副教授贺建奎在其个人社交账号上表示: Colossal公司对物种的定义是危险且有害的。
有科学家则认为,Colossal公司对“物种”的定义具有明显的误导性。其创造的恐狼是经过基因改造的灰狼,并非真正的恐狼,因为它们与已灭绝的恐狼物种的基因组相似度不到 0.1%,只能算是一个在遗传学和表型上都高度近似恐狼的“功能性代理物种” (functional proxy species)。

▲ 图源 Colossal Biosciences
▲ 好物推荐
▉ 吸睛案例:灭绝的恐狼真的“复活”了?
近期,生物技术公司Colossal Biosciences宣布,他们利用CRISPR基因编辑技术,在“复活”已灭绝的史前物种——恐狼(Dire Wolf,《权力的游戏》中冰原狼的原型)方面取得了突破性进展。此消息一出,就登上了时代周刊的封面!

▲ 时代杂志封面
据报道,该公司通过分析从古老化石中提取的恐狼DNA片段,并以其现存最近的亲缘物种——灰狼 (Gray Wolf) 的基因组为基础,进行了多达20处精确的基因编辑 (涉及14个基因中的15个变异)。通过这些编辑,他们旨在“重塑”恐狼的关键遗传特征,并最终成功培育出三只在基因层面高度近似古代恐狼的幼崽。
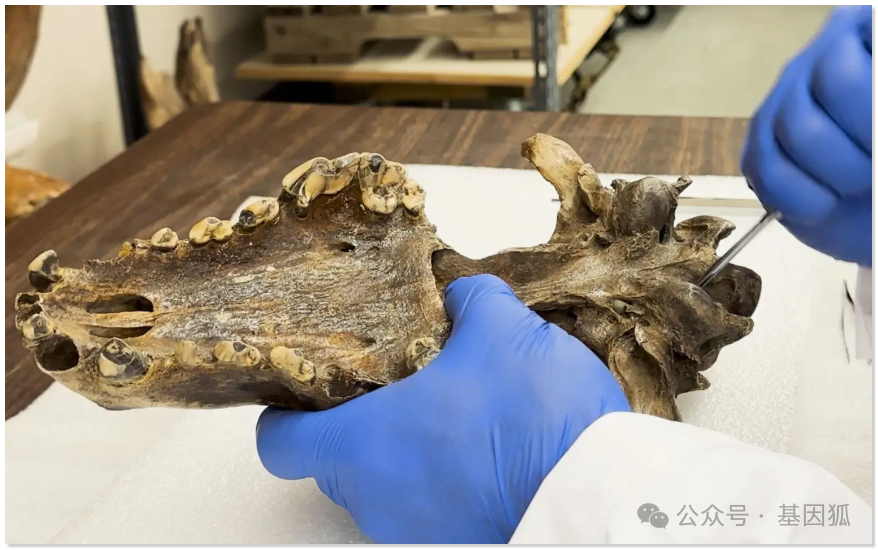
▲ 研究人员从恐狼内耳骨化石中采集古DNA样本
Colossal公司还利用CRISPR技术强化了某些恐狼的标志性外貌特征,例如其可能拥有的雪白色皮毛。这三只“新生”的恐狼 (两只雄性亚成体和一只雌性幼崽) 目前被安置在一个面积达2000英亩的专属保护区内。

▲ 恐狼幼崽Remus
恐狼是真实存在于更新世美洲大陆的大型食肉动物,存在于大约250000年到大约13000年前,大约在1万年前灭绝,其灭绝原因可能与作为其主要食物来源的大型食草动物的消亡有关。Colossal公司的这一尝试,再次将物种复活计划的生态影响、伦理合理性等复杂议题推到了聚光灯下。
▉ 技术进展的伦理拷问:“设计婴儿”与社会公平
然而,当基因编辑技术和体外配子发生技术 (In-vitro Gametogenesis, IVG) 技术结合,并可能应用于人类生殖系编辑时,其潜在的伦理、社会和法律风险就不容忽视。曾创造出“世界首例免疫艾滋病的基因编辑婴儿”的前南方科技大学副教授贺建奎在其个人社交账号上表示:
Colossal公司对物种的定义是危险且有害的。

▲ 贺建奎社交媒体账号
有科学家认为,Colossal公司对“物种”的定义具有明显的误导性。其创造的恐狼是经过基因改造的灰狼,并非真正的恐狼,因为它们与已灭绝的恐狼物种的基因组相似度不到 0.1%,只能算是一个在遗传学和表型上都高度近似恐狼的“功能性代理物种” (functional proxy species)。也人指出,像Colossal这样以盈利为导向的科学研究机构会促使他们夸大其词,这可能会对公众对科学的看法产生负面影响。当然,如果他们能获得百分之百的恐狼基因组,那么未来他们或许能将其植入卵细胞,从而克隆出一只真正的恐狼,这种可能性微乎其微。
部分网友甚至表示:
it's just a fancy grey wolf that they faffed about with.This whole thing reeks of a scam—just a bunch of tech bros trying to cash in on investor hype and buzzwords.It was clearly a big marketing push by them.
它不过是经过一番折腾的灰狼罢了。这整件事都透着一股骗局的味道——不过是些科技圈的家伙想趁着投资者的狂热和时髦术语捞一笔。很显然,这是一场大型的营销活动。 ▉基因编辑+IVG技术突破:实验室“创造”生殖细胞成为可能
那么,恐狼到底是怎么被“创造”出来的呢?到底使用了哪些先进的技术手段呢?其实,该项目的核心逻辑是在现存亲缘关系最近的物种——灰狼的遗传背景下,“重写”了部分关键的基因序列,使其尽可能模拟恐狼的遗传特征和生物学性状。
一、涉及的主要技术有:
- 测序技术: 高通量测序 (NGS),用于古DNA的基因组组装和验证(如Illumina测序平台+Sanger测序平台)。
- 生物信息学工具: 基因组组装软件 (e.g., SPAdes, MEGAHIT for aDNA), 比对工具 (e.g., BWA, Bowtie2), 变异检测软件 (e.g., GATK), gRNA设计与脱靶预测工具 (e.g., CHOPCHOP, CRISPResso2)。
- 基因编辑核心系统: CRISPR-Cas (主要是Cas9, 可能有Cas12a等变体)。
- 分子生物学技术: PCR (定量PCR, 数字PCR), Sanger测序, 各种核酸纯化技术, 质粒构建/病毒载体包装。
- 细胞生物学技术: 哺乳动物细胞培养(特别是成纤维细胞), 细胞转染技术 (电穿孔是常用高效方法), 单细胞克隆筛选与培养, 显微注射/操作。
- 辅助生殖技术 (ART): 卵母细胞体外成熟 (IVM), 体细胞核移植 (SCNT), 胚胎体外培养 (IVC), 胚胎移植 (ET), 代孕母体同期发情处理。
- 动物模型与管理: 健康的灰狼作为细胞供体、卵母细胞供体和代孕母体;专业的动物饲养设施和兽医支持
二、涉及的关键步骤:
DNA提取与基因组测序: 首先,研究团队从两件恐狼的古化石中(一颗发现于俄亥俄州的1.3万年前牙齿,以及发现于爱达荷州的7.2万年前颅骨耳骨)提取到了恐狼的DNA。随后,利用高通量测序,特别是针对降解DNA优化的建库和测序策略,获取尽可能多的恐狼基因组序列片段。
恐狼基因组组装与注释: 利用生物信息学算法,将测得的短序列片段进行拼接、组装,尽可能组装出恐狼的全基因组草图。并对其进行基因注释,识别潜在的基因及其功能区域。
高质量参考基因组构建: 使用灰狼的高质量全基因组序列作为参照基因组和恐狼进行序列比对,发现恐狼与灰狼基因组相似度高达99.5%,因此研究团队选择灰狼作为基础物种进行基因编辑。
比较基因组学分析: 将组装的恐狼基因组与灰狼参考基因组进行比对,利用生物信息学工具鉴定遗传变异,包括:单核苷酸多态性(SNPs)、插入/缺失(Indels)、拷贝数变异(CNVs)以及结构变异(SVs)等。
核心工具选择:CRISPR-Cas系统是首选,最常用的是CRISPR-Cas9,但也可能根据靶点特性、编辑效率或脱靶风险选用Cas12a (Cpf1) 或其他新型Cas蛋白。
向导RNA (guide RNA, gRNA) 设计: 为每个靶点设计高特异性、高效率的gRNA,引导Cas蛋白精确切割基因组预定位置。通常需要利用算法预测gRNA效率和潜在脱靶位点。
修复模板设计 (如需精确替换): 若目标是精确地将灰狼序列替换为恐狼对应序列(例如引入特定的SNP),则需提供一段包含恐狼序列的单链或双链DNA作为同源指导修复(Homology-Directed Repair, HDR)的模板。如果仅需基因敲除或引入小片段Indel,则可依赖细胞自身的非同源末端连接(Non-Homologous End Joining, NHEJ)修复途径。
多重基因编辑 (Multiplex Gene Editing) 策略: 实现20个位点的同时或序贯编辑,需要高效的多重编辑技术。这可能涉及优化gRNA表达载体(如使用tRNA或Csy4处理阵列)、选择能同时递送多个gRNA和Cas蛋白的方法,以及筛选能够耐受多重DNA损伤和修复的细胞。
功能性差异基因识别: 结合比较基因组学结果与古生物学、形态学证据,筛选出那些被认为导致恐狼与灰狼表型差异的关键候选基因或调控元件。Colossal公司的研究团队对灰狼14个基因中的20个位点进行了编辑,引入15个已灭绝的恐狼基因变异。这些变异主要影响表型特征,包括毛色(例如Romulus和Remus的白色毛皮)、毛厚度、体型大小(更大的肩膀和腿部肌肉)、颅骨结构(更宽的头部和更大的牙齿、颌骨)以及特有的嗥叫声和呜咽声。
基因编辑蓝图绘制: 针对每一个目标位点,精确设计基因编辑方案。
靶点编辑验证: 利用PCR扩增目标区域+Sanger测序或靶向深度测序 (Targeted Deep Sequencing),精确确认每个目标位点是否已按预期被编辑。
脱靶效应评估: 进行全基因组测序或利用生物信息学预测+靶向测序验证潜在的脱靶位点 (off-target sites),评估编辑的安全性,筛选出编辑精确且脱靶效应最低的细胞克隆。
供体细胞获取与培养: 从选定的健康灰狼个体(可能经过遗传背景筛选)获取体细胞,最常用的是皮肤成纤维细胞 (fibroblasts),因其易于获取、体外培养和遗传操作。
基因编辑实施: 将设计好的CRISPR-Cas系统元件(Cas蛋白的表达质粒或mRNA,以及多个gRNAs的表达质粒或直接递送的RNA分子,可能还有修复模板)通过高效的转染技术(如电穿孔 (Electroporation)、脂质体转染 (Lipofection))或病毒载体(如慢病毒 (Lentivirus))导入灰狼成纤维细胞中。
编辑后细胞筛选与深度验证: 由于基因编辑效率和精确性并非100%,需进行严格筛选。首先通过单细胞克隆技术分离并扩增单个编辑后的细胞,建立细胞系。然后对这些克隆进行:
获取雌性灰狼的卵母细胞 (oocytes),并在体外使其成熟。
利用显微操作技术,精确移除卵母细胞自身的细胞核(含遗传物质),制备去核卵母细胞 (enucleated oocyte)。
将前一步筛选出的、携带“恐狼化”基因组的灰狼成纤维细胞的细胞核,注入去核卵母细胞胞浆内。
通过化学激活剂(如离子霉素+DMAP/CHX)或电脉冲刺激,模拟受精过程,激活 重构胚胎,使其开始卵裂,发育成早期胚胎(如囊胚 Blastocyst)。
使用到的核心技术:体细胞核移植 (Somatic Cell Nuclear Transfer, SCNT),这是克隆动物的核心技术,也是该项目创造胚胎最可能采用的方法。
胚胎移植 (Embryo Transfer, ET): 将实验室培育的“类恐狼”早期胚胎,通过非手术或手术方式移植到生理状态同步化处理(同期发情)的代孕母体——即生理健康的雌性灰狼的输卵管或子宫内。犬科动物的辅助生殖技术相对复杂,SCNT胚胎的着床率和足月发育率通常低于自然受精胚胎。
妊娠管理与分娩: 对代孕母狼进行密切的妊娠监测。若移植成功,代孕母狼将经历正常的妊娠期(约63天),最终分娩出携带编辑后基因组的幼崽。Colossal宣布成功获得三只幼崽(两雄一雌),表明他们已克服了部分技术瓶颈。
遗传学确认: 对新生幼崽进行遗传检测,再次确认所有目标基因编辑的存在和准确性,并排除非预期的遗传异常。
表型评估: 在幼崽生长发育过程中,持续进行形态学测量、生理指标监测和行为学观察,评估其在多大程度上展现了预期的“类恐狼”特征,并与普通灰狼进行对比。这是一个长期的过程。
饲养与健康管理: 在受控环境(如报道中提及的保护区)下,对这些特殊的动物进行精心的饲养管理和健康监测。
▉ 结语:
CRISPR基因编辑与IVG等前沿技术的融合发展,正以前所未有的速度拓展着生命科学的边界,带来了治疗遗传性疾病、解决不孕不育难题、甚至重塑生态系统的巨大想象空间。
通过对“复活”恐狼的技术拆解我们可以看到,在理论上这类技术的终极发展可能使人类具备筛选甚至“定制”后代某些特定性状 (如外貌特征、认知能力等) 的能力。这直接触及了“设计婴儿” (designer babies) 这一敏感议题,引发了全球范围内关于社会公平性、潜在的基因歧视、对人类基因库完整性的影响,乃至“何以为人”等根本性哲学问题的激烈讨论和深刻忧虑。
然而,技术本身是一把双刃剑。当“编辑生命”的能力日益增强,我们更需以审慎的态度、严谨的科学论证和广泛的社会讨论,来应对随之而来的伦理挑战,确保科技的进步始终服务于人类的长远福祉。未来已来,但如何负责任地拥抱未来,仍需我们共同探索答案。
来源:基因狐
原文地址:https://zhuanlan.zhihu.com/p/1895878437022962459 |
|
 /3
/3 