登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
流式细胞术(Flow Cytometry)作为一种强大的单细胞分析技术,在免疫学研究中具有不可替代的作用。其通过快速、多参数的检测能力,为免疫细胞表型分析、功能研究及疾病机制解析提供了高效解决方案。
一、流式细胞术的技术原理

系统组成与检测对象
流式细胞术通过流体动力学的液流系统、光学系统和强大的电子分析系统,可基于细胞物理特性(大小/颗粒度)及荧光标记信号,实现单细胞水平的精准分析。该技术可检测悬浮细胞或经酶消化的实体组织单细胞悬液,完成细胞计数、分选及多参数生物标志物检测。
通过流体动力学聚焦或声波聚焦技术,使单细胞悬液形成稳定的单细胞样本流。将样本注入流动室之后,被周围压力较高的鞘液流包裹,形成单个细胞排列的液流。
单细胞液流进入流动室的激光照射区,细胞发出的散射光信号和荧光信号分别由相应的探测器收集。
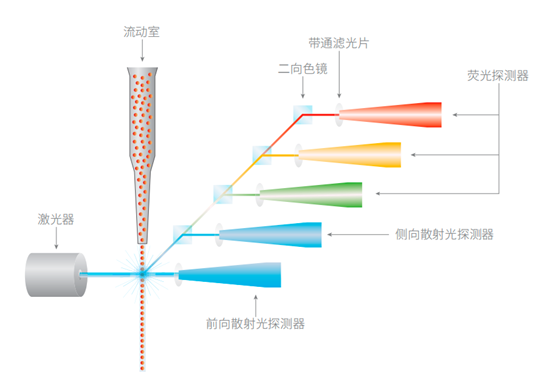
流式细胞术的工作原理:单个细胞排队依次通过激光照射区,一系列光学探测器收集细胞的散射光和荧光信号
利用不同激光光源和不同发射波长的荧光染料,可以同时检测细胞的很多参数。与激光束同轴的透镜收集到的前向角散射光(FSC)反映颗粒相对大小。FSC也会受到细胞与样本缓冲液之间折射率、细胞内部结构、所用光线波长、光学采集元件位置等诸多因素的影响。相反,侧向角散射光(SSC)是在垂直于激光束方向收集到的光线。SSC通过分析细胞内颗粒的复杂程度来区分不同的细胞群。荧光标记抗体或功能染料发出的荧光信号通过一系列透镜和滤光片在特定波长被探测器收集。
<hr/>二、赛默飞流式细胞术产品的优势
赛默飞的流式产品以其精准的工作原理和卓越的性能广泛应用于生命科学研究和临床诊断。

- Invitrogen™ Attune™ CytPix 形态增强型流式细胞仪——Attune NxT流式细胞仪的升级版本,增加了明场成像功能,既保留了传统流式高速、高参数、大数据分析的优势,又增加了明场观察细胞形态、活性等信息,在生命科学研究、细胞治疗和生物技术开发等领域都有广泛的应用前景。
主要技术优势包括:
- 声波聚焦技术:上样速度比传统流式细胞仪快10倍
- 高速成像和AI自动成像功能:6000张图片/秒
- 专利抗堵设计:大细胞、黏细胞轻松上样
- 4激光16个参数:配置灵活,可现场升级
- 具备细胞绝对计数功能,同时可配置流式自动化工作站
更多产品详情,可点击@赛默飞生命科学进行查看。
2. Invitrogen™ Bigfoot 全光谱超高速流式细胞分选仪——全球第一台全光谱、超高速、高性能的流式细胞分选仪,具有强大的光谱解析和分选能力,广泛应用于免疫学研究和生物医药开发领域。
主要技术优势包括:
- 高配置:高达9激光60参数
- 高性能:实时全光谱拆分及传统补偿模式可选
- 高速度:分析速度高达10万个事件/秒,分选速度高达7万个事件/秒
- 高通量:六路分选;96孔-1536孔板适用;单细胞分选
- 自动化:智能型全自动仪器校准及质控
- 安全性:整合式生物安全柜设计及气溶胶管理系统
更多产品详情,可点击@赛默飞生命科学进行查看。
点击样机试用,留资即可申请试用Invitrogen™ Attune™ CytPix 形态增强型流式细胞仪或Invitrogen™ Bigfoot 全光谱超高速流式细胞分选仪,感受赛默飞前沿科技力量,扫除科研障碍。
<hr/>三、免疫学研究中的关键应用
1. 免疫细胞表型分析
现代流式细胞仪可同时检测数十种表面标志物(如CD3、CD4、CD8、CD19、CD56等)和胞内标志物,结合细胞功能标记(如Ki-67、Granzyme B、FoxP3),实现对免疫细胞亚群的精准分型(如调节性T细胞、Th1、Th17细胞、记忆T细胞)。
参考文献——Cossarizza, A., et al. (2019). Guidelines for the use of flow cytometry in immunology. Cytometry Part A, 95(7), 728-758.
结合流式细胞分选技术(FACS),可分离特定免疫细胞亚群用于单细胞测序或功能实验(如体外杀伤实验)。
参考文献——Herzenberg, L. A., et al. (2006). *The history and future of the fluorescence activated cell sorter*. Nature Reviews Immunology, 6(12), 971-976.
2. 免疫反应研究
通过胞内染色技术或分泌型检测技术(如Cytometric Bead Array, CBA)定量分析免疫细胞分泌的细胞因子表达谱,可多维度监测机体的免疫功能状态以及评估疫苗或感染后免疫反应。
参考文献——Maecker, H. T., et al. (2005). *Standardizing immunophenotyping for the Human Immunology Project*. Nature Reviews Immunology, 12(3), 191-200.
使用CFSE(羧基荧光素二醋酸盐琥珀酰亚胺酯)或EdU(5-乙炔基-2'-脱氧尿苷)标记追踪细胞增殖,结合CD69(早期活化标志)、CD25(持续活化标志)评估T细胞响应效率。
参考文献——Quah, B. J., et al. (2007). *The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation*. Journal of Visualized Experiments, 6, 225.
通过MHC-抗原肽四聚体技术或细胞内细胞因子染色(ICS)技术,可分别从结构结合和功能活性两个维度识别抗原特异性T细胞。例如,四聚体技术可以特异性地结合到T细胞受体上,从而识别出针对特定病原体的T细胞。
参考文献——Maecker, H. T., et al. (2005). *Standardizing immunophenotyping for the Human Immunology Project*. Nature Reviews Immunology, 12(3), 191-200.
3. 疾病机制研究
在类风湿性关节炎(RA)和系统性红斑狼疮(SLE)中,流式细胞术用于检测自身反应性T细胞(如CD4+CD25−FoxP3−效应T细胞)和B细胞亚群(如CD27+记忆B细胞)的异常扩增。
参考文献——Crispín, J. C., et al. (2008). *How signaling and gene expression aberrations dictate lupus T cell pathology*. Trends in Immunology, 29(3), 110-115.
通过流式细胞术检测CD40L(CD154)蛋白表达缺陷(诊断X-连锁高IgM综合征)或IL-2Rγ链(CD132)缺失(诊断SCID-X1),结合功能学验证(如STAT5磷酸化、DHR123氧化爆发试验),已成为原发性免疫缺陷病(PID)的实验室初筛金标准。
参考文献——Bousfiha, A., et al. (2020). *The 2019 Update of the IUIS Phenotypical Classification for Primary Immunodeficiencies*. Journal of Clinical Immunology, 40(1), 66-81.
高增殖能力和多种细胞因子的产生与HIV特异性CD8+ T细胞的非进展性相关,而CD4+ T细胞计数下降、CD4+/CD8+ T细胞比例倒置以及CD38+CD8+ T细胞数量增加则与疾病进展相关。这表明流式细胞术可以用于监测HIV感染者的免疫状态和疾病进展。
参考文献——Maecker, H. T., et al. (2005). *Standardizing immunophenotyping for the Human Immunology Project*. Nature Reviews Immunology, 12(3), 191-200.
<hr/>四、流式细胞术未来发展前景分析
流式细胞术在免疫学研究的未来将朝着全光谱、高通量、精准化和智能化方向快速发展。技术层面,高维光谱流式技术(如50+荧光通道) 与单细胞多组学结合(如scRNA-seq联合质谱流式CyTOF)将深度解析免疫细胞异质性;人工智能驱动的数据解析(如UMAP降维与FlowSOM聚类)显著提升复杂免疫图谱的解读效率。应用层面,其核心价值体现在:肿瘤免疫治疗动态监测(如CAR-T细胞耗竭标志物LAG-3/TIGIT追踪)、感染免疫评估(如COVID-19中耗竭性T细胞PD-1+Tim-3+表型分析),以及自身免疫病精准诊疗(如Treg细胞检测指导治疗)。目前存在的挑战集中在临床标准化(如EuroFlow共识协议推广)和低成本微型化技术开发上(如微流控芯片成本降至百元级)。随着空间多组学技术与代谢功能分析的进一步整合,流式细胞术的应用领域越来越广泛,且有望成为免疫微环境研究与个体化医疗的金标准。
参考文献——
1.Deep immune profiling of COVID-19 patients reveals distinct immunotypes with therapeutic implications;
2. EuroFlow antibody panels for standardized n-dimensional flow cytometric immunophenotyping of normal, reactive and malignant leukocytes.
原文地址:https://zhuanlan.zhihu.com/p/1888526246444511476 |
 /3
/3 