金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
SSR(Simple Sequence Repeats ) 又称微卫星 DNA,是一类由几个(多为 1~6 个) 碱基组成的基序 (motif )串联重复而成的 DNA 序列,其长度一般较短,它们广泛分布于整个基因组的不同位置上,每个座 位上重复单位的数目及重复单位的序列都可能不完全相同,因而造成了每个座位上的多态性。SSR 标记数 量丰富,覆盖整个基因组,而且分布均匀,多态性高,呈共显性遗传,重复性好,操作简便,是一种理想 的分子标记技术,被广泛应用于构建基因连锁图分子辅助育种品种鉴定遗传资源的保存等方面。
一、试剂配制
1.0.2%亲水 binding silence(现配现用):1500μL95%乙醇,7.5μL 冰醋酸,再加入 3μLbinding silence, 混匀后使用。
2.0.5%疏水 repel silence(购买后可直接使用)
3.TBE 母液(5×TBE):Tris Base,54g;硼酸,7.5g;EDTA(0.5M pH8.0),20ml.搅拌溶化,定容至 1000ml, 无需灭菌,室温保存,母液的 pH 值应保持在 8.3 左右。
4.Urea-TBE(一块胶板用量): 5×TBE,12ml;尿素,27g.加双蒸水溶解后定容至 51ml,使用漏斗过滤。
5.40%丙烯酰胺:丙烯酰胺,380g;甲叉双丙烯酰胺,20g.加热至 37℃使之溶解,加水定容至 1000ml,用 醋酸纤维素滤膜(入 Nalge 滤器,0.45μm 孔径)过滤,棕色瓶避光保存于室温。
6.10%APS(过硫酸铵):超纯过硫酸铵,2g;超纯水,18ml.溶解后,4℃保存。
7. TEMED(购买后可直接使用):电泳级的 TEMED 可购自JSENB。
8. Loading buffer:去离子甲酰胺 ,50ml;0.5MEDTA(pH8.0),1ml; 二甲苯腈蓝 cyanol,0.125g; 溴酚 蓝,0.125g.混匀后置于 4℃保存。
9.固定液:无水乙醇 50ml,冰醋酸 2.5ml,水 447.5ml。配制成终浓度为 10% 乙醇,0.5% 冰醋酸的 固定液。
10.染色溶液(ACS 试剂):无水乙醇 50ml,冰醋酸 2.5ml,水 447.5ml,AgNO3 1g。配制成终浓度为10% 乙醇,0.5%,冰醋酸,0.2% AgNO3 的染色液。
11.显影溶液:15g NaOH,0.5ml 甲醛,水 500ml。终浓度为 3%NaOH,0.1%甲醛。
二:DNA 提取过程中的注意事项
(1) 避免试验材料间 DNA 的交叉污染或外来 DNA 的污染。使用冷冻干燥叶片法,可以将每个样品在单 独的离心管中研磨,研磨使用的小钢珠球最好是一次性的,如果是反复使用的小钢珠球,必须彻底清洗干 净使用液氮和研钵研磨叶片组织时,必须在每次研磨前彻底清理干净研钵和研磨棒。
(2) 试验材料应选取幼嫩组织,因为植物幼嫩组织 DNA 含量高,且多糖多酚含量少。
(3) 装入离心管的叶片组织最好不要超过离心管的 1/3-1/2,否则会引起细胞裂解不完全,导致产量和纯 度下降。
(4) 使用液氮研磨时,要先将研钵用液氮冷却,在加入液氮后,要先将叶片压碎,研磨时要快速用力,尽 量使样品磨成粉末状。
(5) 水浴前需要确保试管盖盖严,或使用辅助工具进行加固,以防止水浴时因温度较高导致试管盖开裂。
(6) 水浴过程中,每隔 10-15min 将离心管取出振荡摇匀,使粉碎的叶片组织尽量与裂解液充分接触,破 坏细胞结构,释放 DNA。
(7) 实验过程中振荡动作不宜剧烈,移液枪头最好使用大孔枪头,移液动作不能太快,以免使 DNA 断裂。
(8) 当 DNA 以小球状固体沉积在离心管底部后,倾倒离心管中多余液体时,应避免把 DNA 小球一起倒 出 可在倒去大部分液体后,改用吸水纸吸取剩余液体。
(9) DNA 风干最好在无菌操作台上进行,待乙醇彻底风干后才能加入 TE 或 ddH2O 溶解,如果有残留的 乙醇,可能会影响 PCR 反应的试验结果。
(10) 如果 DNA 纯度不好,可将粗提物用溶液 1×TE 充分溶解,离心后,取上清液再次沉淀 DNA,可有 效除去多糖。

三:实验步骤
1、玻璃板清洗:
1)用洗涤剂把玻璃反复擦洗干净,用酒精擦干、干燥。在疏水玻璃板上均匀涂上 300-500μL 的 0.5%的疏水剂 Binding Silane。可放置过夜。
2)配制凝胶前,在亲水玻璃板上均匀涂上 2%的亲水剂 Repel Silane,保证玻璃板的每个地方都涂上亲 水剂,晾干至少 5min,然后用酒精轻轻擦拭以去掉多余的亲水剂。
3)玻璃板彻底干燥后进行玻璃板组装。两块玻璃板两边边缘割伤配套的硬纸条,橡皮夹子夹住两边,在 橡皮夹子里加上硬纸片可以保证玻璃板的水平,可以有效地防止条带跑歪。下边套上有旋钮的塑料套,旋 紧旋钮,以防止底下漏胶在插入梳子的位置插入一个硬纸条以保证上方凝胶界面水平且整齐。
4)将装好的玻璃板水平放置于桌面上,亲水玻璃板至于下面,而带电极的疏水玻璃板朝上,保证玻璃板 的水平。
2、聚丙烯酰胺凝胶的制备
1)每一块胶的用量配制如下:(大胶)
Urea-TBE 51ml
40%丙烯酰胺 9ml
10%APS 400μl
TEMED 30μl
共计 约 60ml
2)迅速轻轻摇匀,注意不要用力搅拌,混匀后立即灌胶。
3)将混合液导入大注射器中,将导管中气泡挤出,迅速将导管口插入灌胶口,在重力作用下,混合液流 入两块玻璃板之间,人为控制流速以防止气泡产生。
4)灌胶完成后,聚合时间至少在 1 小时,若凝胶要放置过夜,则须在凝胶两头铺上湿滤纸(以 1×TBE 浸湿)以防止凝胶变干。4℃保存,凝胶使用之前可保存 1-2 天。
3、凝胶电泳
1)正极槽(底下)中加入 600ml 的 1×TBE 缓冲液,组装上配好凝胶的玻璃板,拔去维持凝胶上方水平的硬纸条,负极槽上加入 800ml 的 0.5×TBE 缓冲液直至覆盖了凝胶上方。
2)将凝胶上方多余的胶用枪冲洗干净,并将气泡清除。
3)预电泳 30min,保持在恒定功率 55W(相当于电压 1441V,电流 38mA)。
4)预电泳完成后,关闭电源,用枪将凝胶上方多余的气泡和胶清除干净,插入梳子,再用枪将梳子中的 气泡清除干净。
5)加入 3μl 已由 loading buffer 处理过的样品 DNA,每块板子可点 1-3 个 Marker,55W 恒定功率电 泳 1.5h,至第一条 Loading buffer 指示带(二甲苯青带,约相当于 260bp 双链 DNA)跑至胶板的 2/3 处(距底部 1/3 处)时停止电泳。
6)通过带电极玻璃板中部的出水孔排出 0.5×TBE 缓冲液,剩余的 0.5×TBE 缓冲液直接倒掉,缓冲液可 反复使用几次。
7)小心的分开两块玻璃板,这时凝胶会粘连在涂有亲水剂的玻璃板上。
4、银染
1)将带凝胶的玻璃板浸在固定液(10% 乙醇,0.5% 冰醋酸)中 20min,凝胶朝下放置,玻璃板位于 上方。
2)将玻璃板取出,浸在染色液(10% 乙醇,0.5% 冰醋酸,0.2% AgNO3 (ACS 试剂))中 15min, 凝胶朝下放置,玻璃板位于上方。
3)用自来水(最好用双蒸水)短时间(5-10s)冲洗玻璃板两面,玻璃板须离水近些,否则凝胶容易变 黑。
4)将凝胶浸在显影液(3%NaOH,0.1%甲醛)中,显影 20-30min,直至带纹出现。凝胶朝上放置。
5)用自来水(最好用双蒸水)冲洗凝胶两遍,每次 2min。
6)室温下自然干燥,干燥后的胶板覆盖保鲜膜,可以永久保存,也可以进行拍照记录。
四、PCR 反应
1、模板及引物配制
1)模板 DNA:使用 25ng/μl 的 DNA 作为模板。
2)引物:母液 250M,取 10μl 的母液加水至 100μl 即得到 25μM 的引物。
2、DNA 片段扩增:
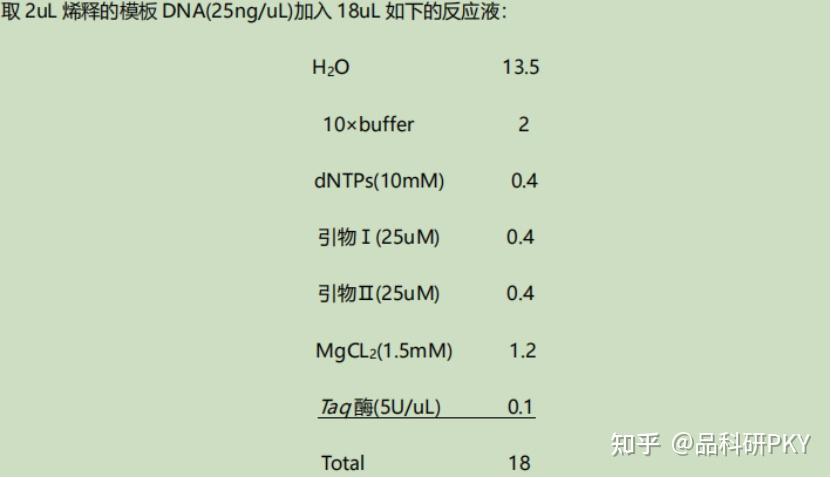

扩增后的样品中加入 3/4 体积的 Loading Buffer,混合,95℃变性,待用。
五:PCR 反应实验操作注意事项
PCR 反应过程中应特别注意不要使样品相互污染, 以免造成试验结果不准确, 同时也要注意所加试 剂或样品必须是经过混匀后的液体, 这样才能保证反应液各成分的浓度和体积的均一性 所用试剂需从正 规商家购进, 以保证试剂的质量。
( 1) 尽量使用一次性手套 专用整套移液器 成套试剂和其他必需品, 避免外来 DNA 污染反应体系( 2) DNA 模板应稀释为适宜的浓度, 使加入 PCR 反应的 DNA 样品体积最好在 4 ~ 5 l 如果 DNA 模板 样品量太少, 仅有 1 ~ 2 l, 不仅实验操作难度大, 而且如果操作时间长, 会导致 DNA 反应液部分 或全部蒸发掉, 影响 PCR 反应结果。
( 3) 可以先将 DNA 样品加到 PCR 管底部, 再加其他 PCR 反应混合液 加样时选择不同的方位加DNA 模板和其他 PCR 反应混合液, 这样枪头靠壁加样时不会交叉污染。
( 4) 加样完毕后, 盖上盖子, 混匀反应液, 再低速离心片刻( 1 min 左右) 如果不是立即进行 PCR 扩 增, 需将 PCR 反应混合液置于 - 20 ℃保存备用。
( 5) PCR 扩增反应使用的酶不能长时间放置于室温下, 须随用随取, 使用完毕后立即放回 - 20 ℃ 冰箱否则, 酶易失活。
( 6) PCR 反应的退火温度应根据不同的引物来确定最佳退火温度, 以确保扩增的条带中杂带少, 目标 带明显, 引物退火温度一般按照 Tm = 4 ℃( G + C) + 2 ℃( A + T) 公式计算。
品科研-生物试剂,化学试剂,科研试剂超市www.pinkeyan.com
-----------------------------------------------------------------------------------------------------------------------------------北京德航五洲科技有限公司&河北品科研生物科技-品科研超市http://www.pinkeyan.com作为中国生命科学试剂零售业的翘楚,科学家身边的一站式试剂超市,服务客户覆盖清华大学、北京大学、中国科学院、中国医学科学院、中国农业科学院、北京生命科学研究所等知名高校和科研院所,同时覆盖万泰药业、安图生物、博晖创新、国生生物等诸多上市企业。 |
|
 /3
/3 