金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
CRISPR诊断被称为下一代分子诊断技术,美国FDA和中国NMPA都颁发过CRISPR诊断平台的新冠诊断EUA授权,而前几天上海伯杰医疗“恒温CRISPR法新冠快检试剂盒”获批的消息无疑进一步激发了大家对CRISPR诊断的热情。CRISPR诊断主要包含样本前处理(含预扩增)、靶标识别、信号释放和检测几部分。
本文将主要介绍CRISPR诊断方法所采用的信号报告系统,主要是荧光淬灭、侧向层析和电化学三种方法(相关的内容,James Collins和张锋团队于今年7月发表于Nature Biomedical Engineering的综述文章中有过简单介绍
1 )。1、为什么是CRISPR?装着瞄准器的霰弹枪!
CRISPR技术被用于分子诊断主要因为特异性:在向导RNA的引导下,CRISPR-Cas蛋白识别靶标序列的特异性极佳,甚至可以精确区分单碱基差异。另外,Cas蛋白接触靶标序列后会被激活出无差别的反式切割活性,无差别的一阵刀光剑影,将周围一切可切割的核酸序列高效切割,从而起到放大信号的作用。同时具备特异性识别和无差别切割特征的CRISPR诊断系统简直就是一把装着瞄准器的霰弹枪。
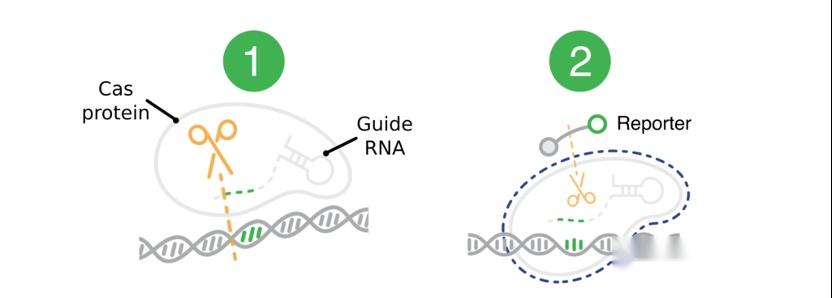
图1. Cas蛋白识别和切割靶标序列的示意图。图片摘自猛犸生物的官方网站。Cas蛋白通过向导RNA特异性识别并结合靶标序列(对于dsDNA靶标,则需要PAM序列),形成三元复合物,在顺式切割靶标序列的同时也激发出反式切割活性,将周围的核酸序列进行无差别的切割。目前,鉴定的有顺式和反式切割活性的Cas蛋白主要集中在Cas12和Cas13两类蛋白,分别识别(/切割)DNA序列和RNA序列。
2:CRISPR的信号报告系统
由于Cas蛋白只有在特异地识别和结合靶标序列后才切割周围的核酸序列,因此通过检测报告序列是否被切割就可以判定待检体系中是否存在靶标序列。几乎所有的CRISPR诊断方法都通过向体系中加入某些可被检测的外源探针来完成诊断的流程。
2.1:荧光淬灭法
首次利用CRISPR进行靶标核酸检测的时间应该可以追溯到2016年,Jennifer团队在Nature上发表了Cas13a反式切割活性鉴定的工作,并首次利用Cas13a反式切割活性来切碎荧光淬灭探针,使得探针不被淬灭并发光,从而完成了对靶标RNA的检测
2 。到了2017年,张锋团队和James Collins团队合作开发了SHERLOCK诊断方法,也是利用了Cas13的反式切割活性3 :通过在体系中加入外源的单链报告探针,探针两端分别标记荧光基团和淬灭基团修饰。当探针被Cas蛋白切断,淬灭基团和荧光基团分离导致荧光淬灭失效,荧光基团恢复活性。相比于Jennifer的工作,SHERLOCK引入了靶标扩增的环节,从而将检测灵敏度提高到了aM级别,使得CRISPR诊断真正具备了实用价值。
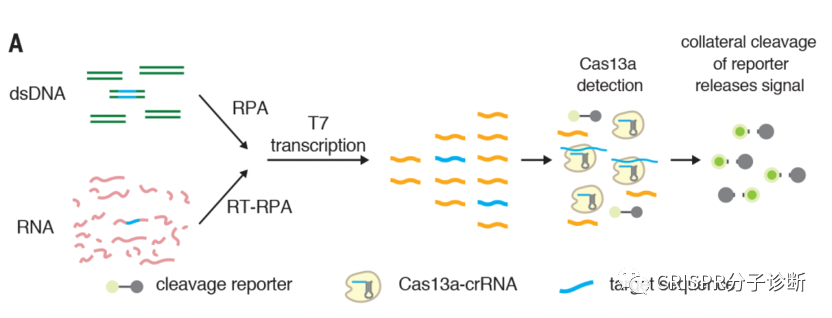
图2. CRISPR诊断荧光淬灭法的信号示意图。图片摘自SHERLOCK系统
3 在此之后,几乎所有CRISPR分子诊断方法都在检测体系中加入了外源报告探针,并逐渐形成了不同的信号检测系统。其中,荧光淬灭法是一种技术成熟且已经被广泛用作分子诊断的信号报告系统,用于CRISPR诊断时不需要任何新的设计,几乎算是无缝衔接。
然而在应用上,荧光淬灭属于液相体系,如果想在同一管内做多重检测的话还是比较费劲的,也需要多色荧光设备,所以今年Jennifer团队开发的免扩增检测新冠的FINTD-IT系统就采用的是双管法,每管还是只检测一个靶标
4 。2.2:电化学传感器
电化学传感器法也能和CRISPR诊断系统进行无缝衔接,最直接的方式是用探针将电化学活性物质偶联到电极上,产生较强的电信号响应。由于探针被切割后会使活性物质脱离电极,信号响应降低,故可以通过信号响应的变化来进行诊断。
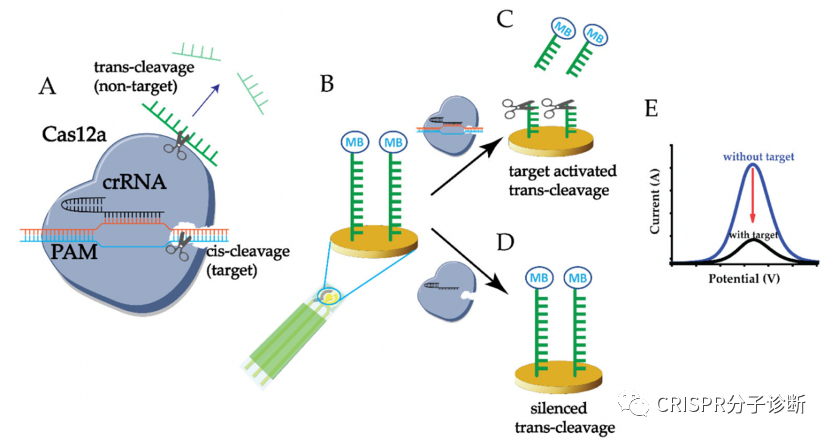
图3.基于CRISPR和电化学原理的E-CRISPR系统
5 。电化学传感器和CRISPR的结合出现也很早,2019年就出现了,详见我们前期报导的E-CRISPR系统
5 。此外,也有不少新模式,例如可以将酶通过探针偶联到电极,通过酶催化在原位产生电化学活性物质,比如将葡萄糖氧化酶等通过探针偶联到电极的CRISPR-Biosensor X6 。还有一种思路是对偶联到电极的探针本身在切割前后在电极上的固化量差异进行检测,比如在切割反应结束后,通过银增强的方法将银离子固化到探针表面来增强电极信号。探针被切割后信号会减弱,通过这个方式来确定探针是否被切割
7 。总之,基于CRISPR的电化学的方法有非常多的系统,有兴趣的话,可以阅读之前的文章(CRISPR电化学文章之1,2,3,4,5,6,7)。2.3:侧向层析试纸条
当大家都在荧光淬灭的路上狂奔时,张峰团队推出了SHERLOCKv2,引入核酸试纸条作为信号报告系统,非常便于POCT使用
8 。他们在探针的两端分别引入两个小分子标记物FAM和生物素。而他们使用的商品化核酸试纸条将抗FAM抗体用胶体金标记,NC膜上检测线处包被有可结合生物素的链霉亲和素,这种试纸条的原本用途是通过夹心法检测同时含有FAM和生物素的核酸扩增产物。
张锋团队则开创性地改变了试纸条本身的判读方式,将这种夹心法试纸条的质控线作为检测线来检测探针是否被切割。他们调整探针浓度,保证在探针未被切割时,所有胶体金都集中在下面那条线,而一旦探针被切割,就会有胶体金越过下面的线到达上面的线显色。
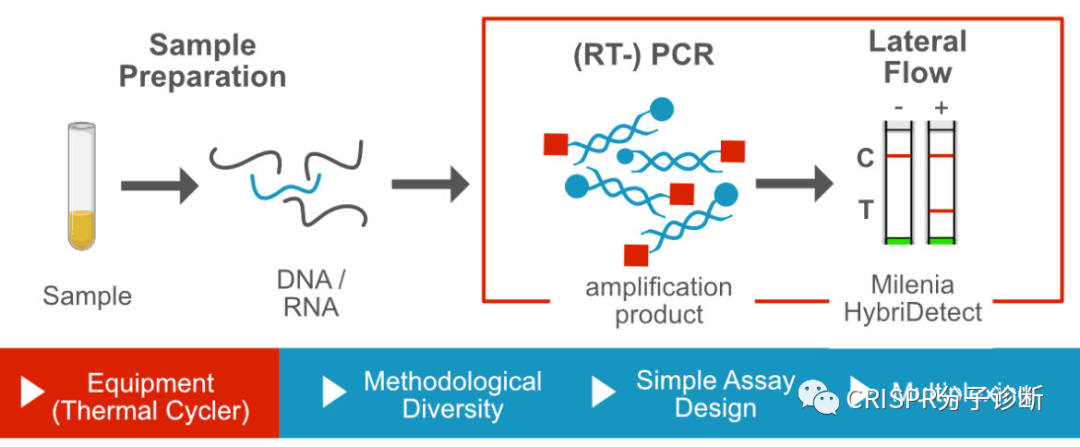
图4.侧向流层析试纸条工作原理。图片摘自Milenia公司官网。该试纸条开发的最初用途是检测同时含有FAM和Biotin的产品(如上图),在张锋开发出其CRISPR用途后,Milenia公司也在官网展示了其CRISPR诊断方向的用途。
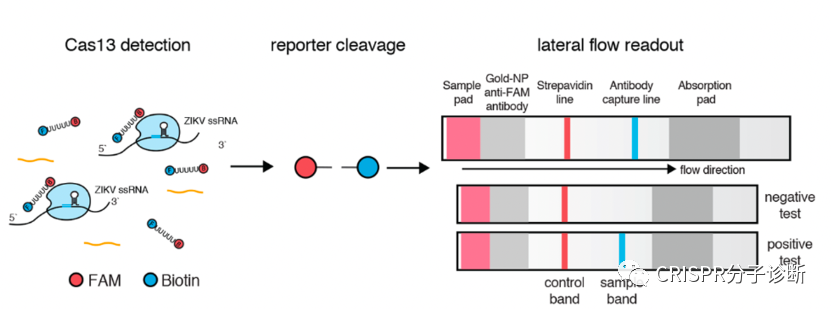
图5. CRISPR诊断侧向层析法的工作原理。图片摘自SHERLOCKv2系统
8
将这种夹心法的试纸条通过竞争法方式进行判读的设计,非常巧妙。好处在于摆脱对仪器的依赖,可以更好地走向POCT。前段时间James Collins团队开发的、火爆全网的、可以检测新冠的口罩系统,也是采用这种方式
9 。但是这种试纸条弊端,必须调整探针浓度适应试纸条。另外,从SHERLOCKv2、STOPCovid、STOPCovid.v2、HOLMESv2等这些方法的文章中可以发现,该公司的试纸条并不能保证阴性时候没有检测线。另外,通过这种方式也很难做多指标检测,难以在检测的同时添加内质控,不过这方面已经有一些新进展了。
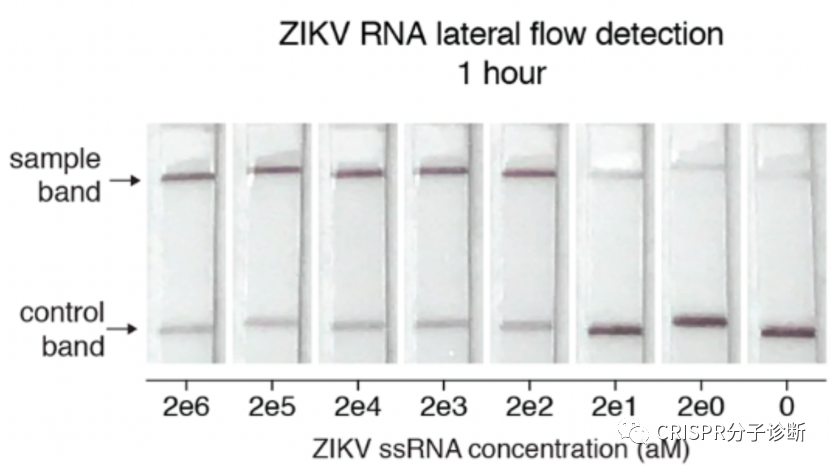
图6. CRISPR诊断侧向层析法的结果解读。图片摘自SHERLOCKv2系统
9 。如上图最右条检测条带所示,在检测阴性样本时,也会出现淡淡的T线,从而会给检测结果的判读带来困扰。
2.4改装与混搭
以上介绍的三类是基本的方法,此外还有很多调整或者混合使用的方法。比如电极方法,电极除了作为信号捕获方式,还可以是电化学发光的激发工具,所以,有文章采用的设计是当将淬灭基团通过核酸偶联到电极,核酸被切割后,淬灭基团脱落,导致发光
10 (详见电化学免扩增直检系列之3)。另外,胶体金同时具有荧光淬灭和金属荧光增强两种作用,距离足够近时起到荧光淬灭功能,一定范围内又有金属荧光增强作用。所以就有团队通过两种方式将荧光基团FITC用单链偶联到胶体金上,核酸切割后导致胶体金和荧光基团距离达到荧光增强的要求
11 。也可以将荧光基团置于两个胶体金颗粒之间,一个淬灭一个增强,其中导致荧光淬灭的胶体金可以在核酸被切割后脱落12 。试纸条检测的方法也多种改进方式,有将探针一端标记,一端固定到磁珠等微球表面,或者用探针将胶体金和磁珠相连,最后用试纸条进行检测的,也有团队在探索单条多联检。
还可以将这些技术与酶、适配体、微流控、放大体系等混搭。比如聂舟团队开发的CONAN(柯南),采用荧光淬灭的方法,但巧妙的设计了一套探针,该探针含有封闭起来的靶标,被切割后靶标释放,进一步激活Cas蛋白,达到自激活放大信号的效果
13 (详见CRISPR免扩增系统(4):名侦探柯南CONAN)。甚至还有些方法根本不利用顺式和反式切割,而是单纯利用Cas蛋白-探针复合物可以和目标序列结合的能力,在Cas蛋白和引物序列上分别做标记来进行检测
14 。总之,CRISPR系统作为细菌获得性免疫的重要组成部分
15 ,在分子诊断领域带给大家的是无限想象空间,毕竟在半个世纪前,对限制性内切酶(细菌先天免疫的重要组成)的研究开启过一个时代16 。现状是,自CRISPR诊断技术发明以来,大量的科研团队IVD企业已经进场,粗略统计,SHERLOCK有名有姓的兄弟及远房亲戚都已经有几十个了。参考文献:
1 Kaminski MM, Abudayyeh OO, Gootenberg JS, Zhang F, Collins JJ. CRISPR-based diagnostics.Nat Biomed Eng2021;5:643-656.
2 East-Seletsky A, O%27Connell MR, Knight SCet al.Two distinct RNase activities of CRISPR-C2c2 enable guide-RNA processing and RNA detection.Nature2016;538:270-273.
3 Gootenberg JS, Abudayyeh OO, Lee JWet al.Nucleic acid detection with CRISPR-Cas13a/C2c2.Science2017;356:438-442.
4 Liu TY, Knott GJ, Smock DCJet al.Accelerated RNA detection using tandem CRISPR nucleases.Nat Chem Biol2021;17:982-988.
5 Dai Y, Somoza RA, Wang Let al.Exploring the Trans-Cleavage Activity of CRISPR-Cas12a %28cpf1%29 for the Development of a Universal Electrochemical Biosensor.Angew Chem Int Ed Engl2019;58:17399-17405.
6 Bruch R, Johnston M, Kling Aet al.CRISPR-powered electrochemical microfluidic multiplexed biosensor for target amplification-free miRNA diagnostics.Biosens Bioelectron2021;177:112887.
7 Suea-Ngam A, Howes PD, deMello AJ. An amplification-free ultra-sensitive electrochemical CRISPR/Cas biosensor for drug-resistant bacteria detection.Chem Sci2021.
8 Gootenberg JS, Abudayyeh OO, Kellner MJ, Joung J, Collins JJ, Zhang F. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6.Science2018;360:439-444.
9 Nguyen PQ, Soenksen LR, Donghia NMet al.Wearable materials with embedded synthetic biology sensors for biomolecule detection.Nat Biotechnol2021.
10 Liu PF, Zhao KR, Liu ZJ, Wang L, Ye SY, Liang GX. Cas12a-based electrochemiluminescence biosensor for target amplification-free DNA detection.Biosens Bioelectron2021;176:112954.
11 Choi JH, Choi JW. Metal-Enhanced Fluorescence by Bifunctional Au Nanoparticles for Highly Sensitive and Simple Detection of Proteolytic Enzyme.Nano Lett2020;20:7100-7107.
12 Choi JH, Lim J, Shin M, Paek SH, Choi JW. CRISPR-Cas12a-Based Nucleic Acid Amplification-Free DNA Biosensor via Au Nanoparticle-Assisted Metal-Enhanced Fluorescence and Colorimetric Analysis.Nano Lett2021;21:693-699.
13 Shi K, Xie S, Tian Ret al.A CRISPR-Cas autocatalysis-driven feedback amplification network for supersensitive DNA diagnostics.Sci Adv2021;7.
14 Osborn MJ, Bhardwaj A, Bingea SPet al.CRISPR/Cas9-Based Lateral Flow and Fluorescence Diagnostics.Bioengineering %28Basel%292021;8.
15 Mojica FJ, Diez-Villasenor C, Garcia-Martinez J, Soria E. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements.J Mol Evol2005;60:174-182.
16 Roberts RJ. How restriction enzymes became the workhorses of molecular biology.Proc Natl Acad Sci U S A2005;102:5905-5908.
原文地址:https://zhuanlan.zhihu.com/p/16730052263 |
|
 /3
/3 