金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
在生物技术领域,CRISPR-Cas9技术的出现被誉为一次科学革命,它不仅改变了我们对基因编辑可能性的理解,而且也正在重塑我们对遗传疾病治疗和生物研究方法的认知。
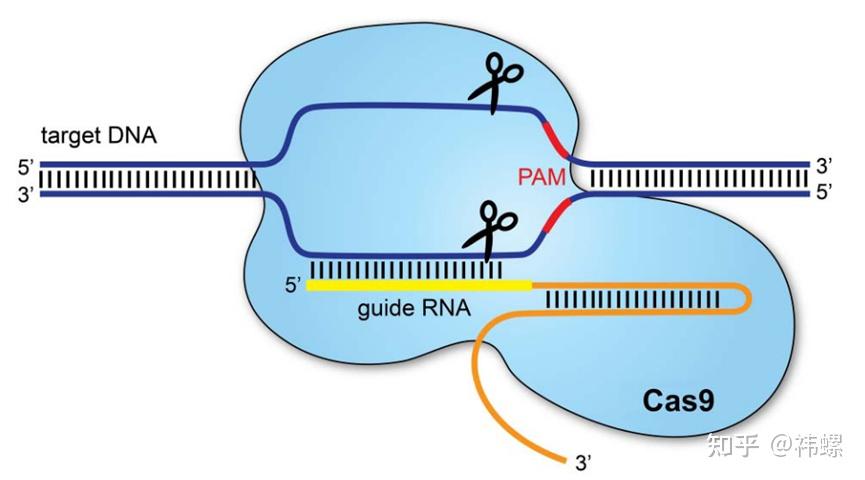
图. CRISPR/Cas9 系统 [1]
CRISPR-Cas9源自细菌的一种自然免疫机制,该机制能够识别并剪切入侵的病毒DNA,从而保护细菌免受外部遗传物质的侵害。科学家们通过研究这一天然现象,开发出了一种可以在几乎任何生物体内精确修改基因的工具。这种技术的开发不仅仅是一个技术性的突破,它的应用前景和挑战也是当前科学研究的热点话题。
<hr/>技术原理:
- CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats,成簇规律间隔短回文重复序列)是一类在细菌和古菌的基因组中发现的DNA序列。这些序列由重复的基序和间隔序列组成,间隔序列通常来源于过去入侵的病毒DNA。
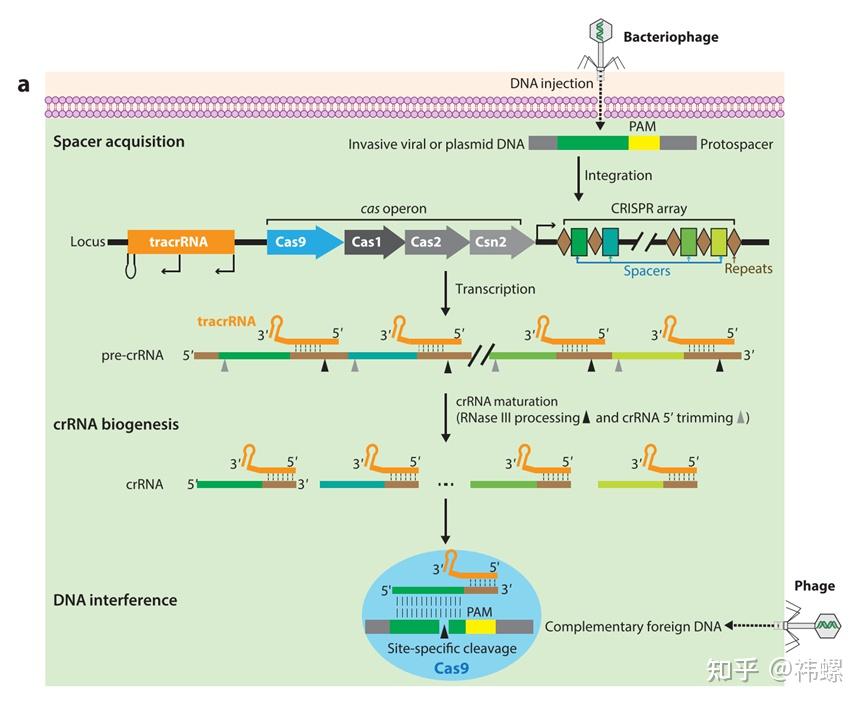
图. CRISPR-Cas系统中典型的CRISPR位点的结构和功能流程 [2]
- Cas9(CRISPR-associated protein 9,CRISPR相关蛋白9)是一种核酸酶,它在CRISPR-Cas9系统中负责识别并切割DNA。Cas9的功能依赖于与之配对的gRNA,这种RNA包含了一个与目标DNA序列互补的区域,使得Cas9能够精确地识别和结合到特定的DNA序列。一旦识别并结合到目标DNA,Cas9会在特定位置(通常是在所谓的PAM序列附近)进行双链切割。
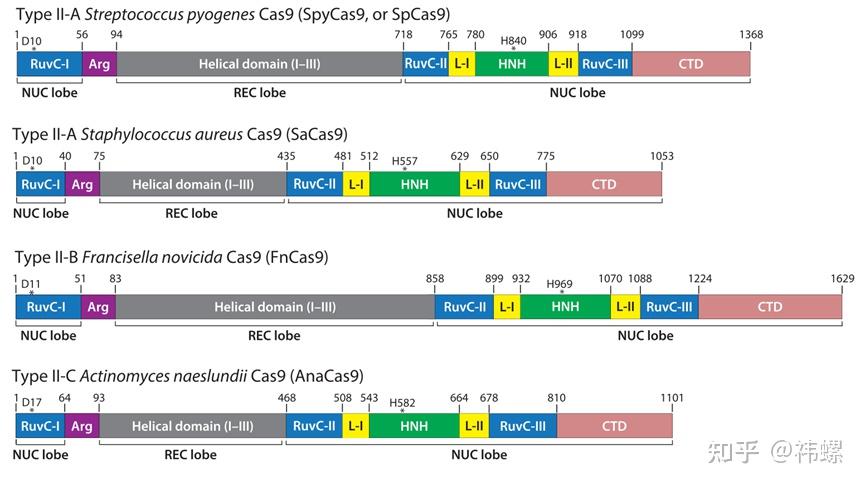
图. 不同亚型的Cas9同源酶的结构域 [2]
- 指导RNA(guide RNA, gRNA)是CRISPR-Cas9系统中的关键组成部分,它由两部分组成:CRISPR RNA(crRNA)和辅助RNA(tracrRNA)。在实际应用中,这两个RNA通常被合成为一个单一的导向RNA分子(sgRNA)。sgRNA的设计使其能够通过互补配对精确识别目标DNA序列。
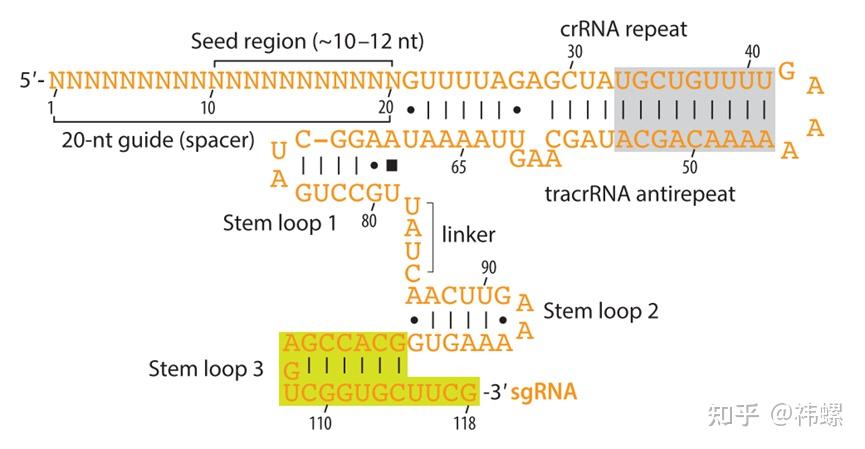
图. sgRNA二级结构的示意图 [2]
- 目标识别和DNA切割:CRISPR-Cas9系统的工作开始于sgRNA和Cas9蛋白形成复合体,并导航至目标DNA。sgRNA的一部分与目标DNA的互补序列结合,而这种结合通常需要在目标序列旁边存在一个短的PAM序列(原核效应因子动员位点)。PAM序列是Cas9识别和结合DNA所必需的。
一旦Cas9酶通过sgRNA被正确地引导到目标位置,它就会在特定位置对DNA双链进行切割。这种切割导致DNA双链断裂(double-strand break,DSB),触发细胞的DNA修复机制。
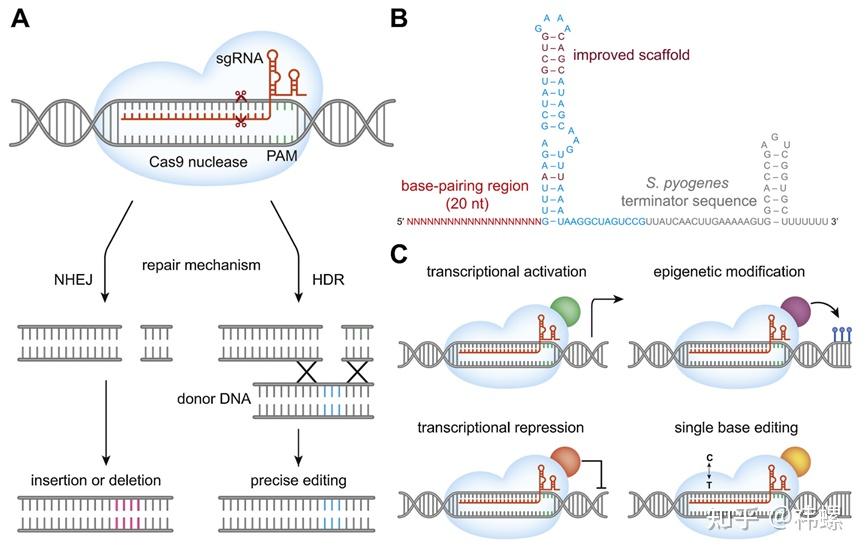
图. CRISPR/Cas9功能及其SpCas9变体概述
图注:(A) Cas9核酸酶依靠其绑定的sgRNA互补配对,定位到目标DNA。该位点后必须跟有3′ PAM序列(NGG、NAG),并通过切割双链DNA触发修复机制,包括非同源末端连接(NHEJ)或同源定向修复(HDR)。(B) sgRNA的结构包括20个核苷酸的目标序列和一个为Cas9结合设计的手柄区域。通过特定碱基增强了sgRNA的稳定性。(C)几种SpCas9融合蛋白及其生物效应:激活型的dCas9-VP64(绿色),抑制型的dCas9-KRAB(红色),以及进行表观遗传修饰的dCas9-DNMT3A(紫色)和进行单核苷酸编辑的dCas9-AID(黄色)。
- DNA修复:细胞尝试修复DSB主要通过两种途径:非同源末端连接(NHEJ)和同源定向修复(HDR)。NHEJ是一种错误倾向的修复过程,可能在修复处引入插入或缺失,常用于基因敲除。而HDR则是一种高精度的修复机制,如果在编辑过程中提供了同源DNA模板,可以在特定位置精确地插入或更正DNA序列。
CRISPR-Cas9技术的这些基本原理使其成为一种强大的基因编辑工具,能够在多个生物学系统中进行高效和精确的基因修改。通过这种技术,科学家们能够探索基因的功能,治疗遗传病,甚至创建经过改良的作物和动物模型。
<hr/>技术应用:
CRISPR-Cas9技术的应用领域广泛,从基础科学研究到临床应用、农业和生物工程等多个领域都有显著的影响。
1. 基因功能研究
CRISPR-Cas9技术使科学家能够在细胞和动物模型中精确敲除或修改特定基因,从而研究这些基因的功能和相关病理机制。例如,通过敲除某个基因,研究者可以观察到失去该基因表达后的生理变化,从而揭示其在生物体中的作用。目前,CRISPR-Cas9技术在基因功能研究领域的应用已在许多的科学期刊中发表。
https://pubmed.ncbi.nlm.nih.gov/?term=crispr-cas9+knockout

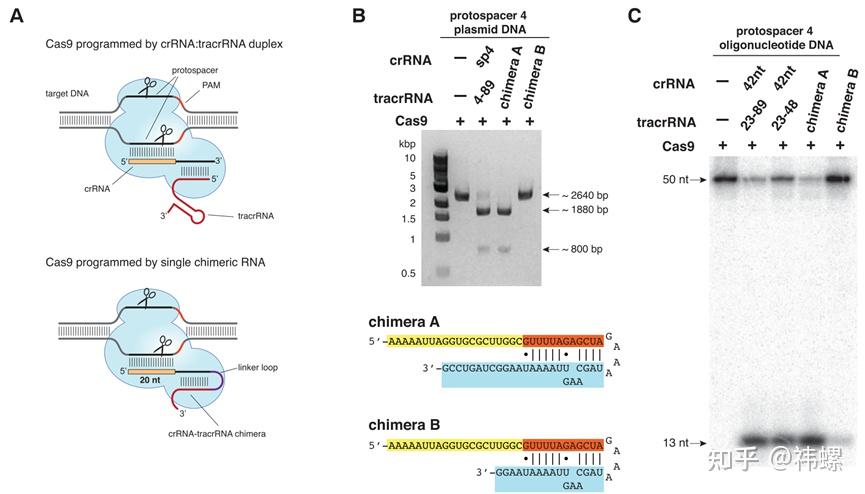
这篇文章首次描述了CRISPR-Cas9系统可以被编程来切割特定的DNA序列 [3]。
2. 遗传疾病治疗
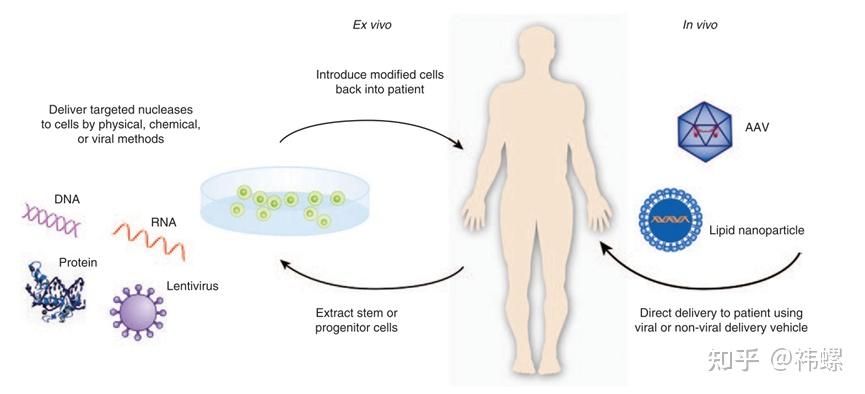
CRISPR-Cas9技术的另一个重要应用是在治疗遗传性疾病方面。通过直接修正患者基因组中的致病基因突变,可以根本性地治疗疾病。例如,CRISPR已被用于在体外模型和临床前试验中纠正β地中海贫血和镰状细胞病的基因突变。

这篇综述讨论了CRISPR-Cas9技术在基因和细胞治疗中的应用,包括治疗遗传性疾病的潜力 [4]。
3. 农业改良
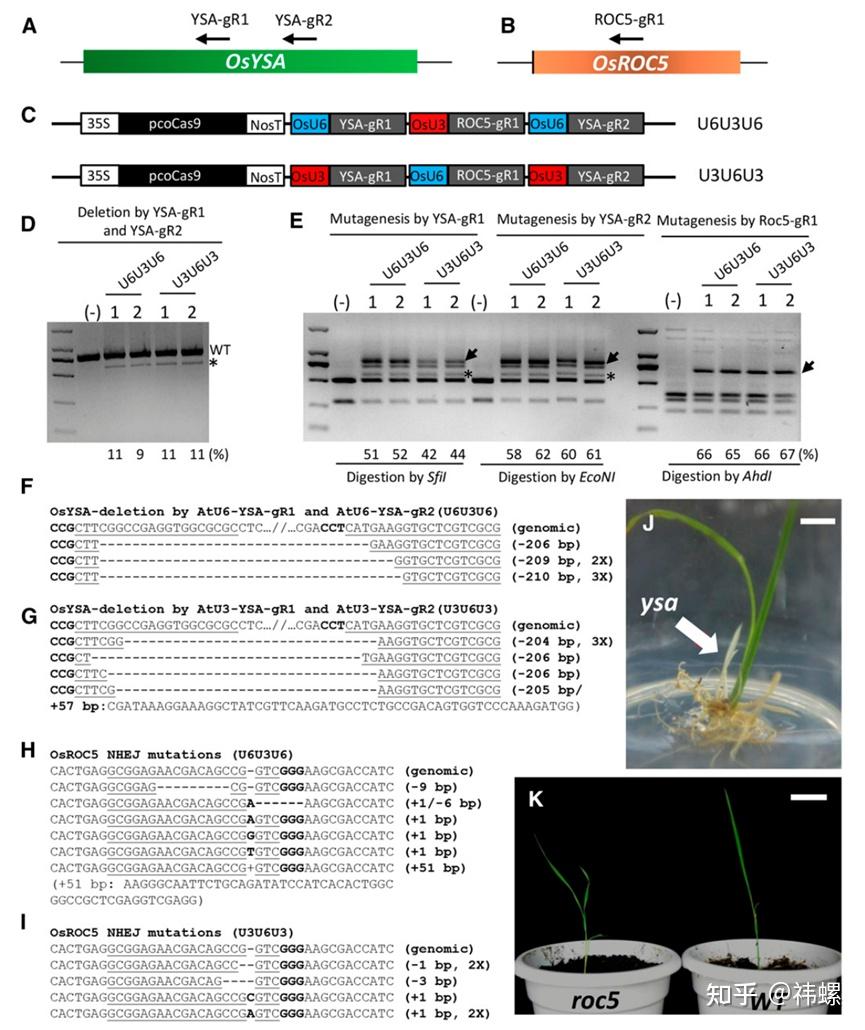
在农业领域,CRISPR-Cas9技术被用来增强作物的耐病性、耐旱性和营养价值。通过编辑作物基因,科学家可以开发出更适应环境变化的新品种,例如抗虫害的玉米和高产量的水稻。

该文描述了CRISPR-Cas9在作物基因编辑中的多种应用,包括提高抗病性和改善农艺性状 [5]。
4. 微生物工程
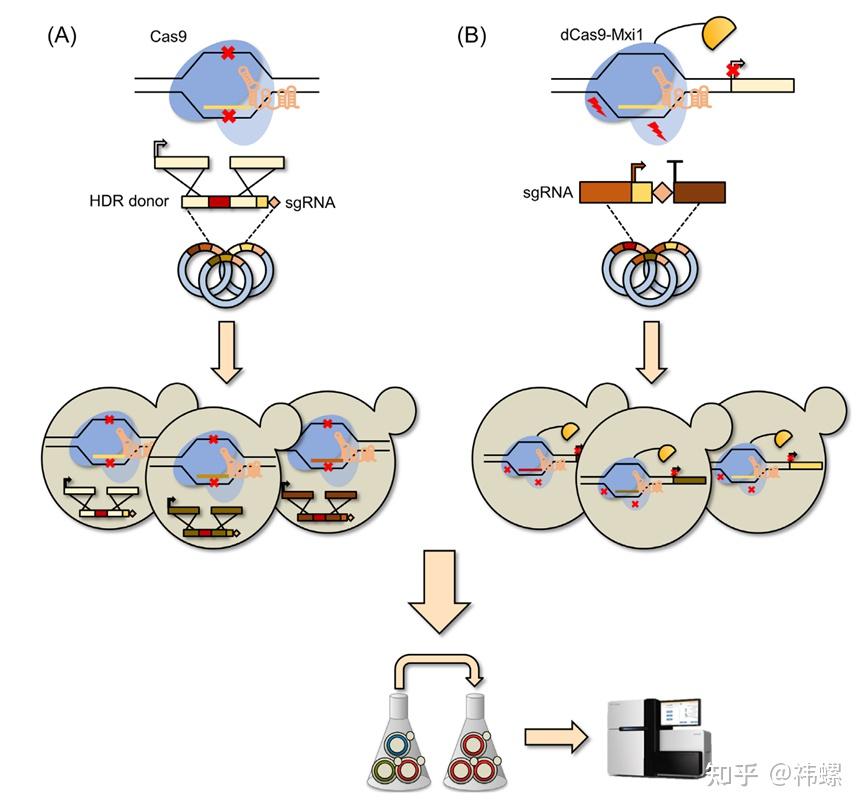
CRISPR-Cas9技术在微生物工程领域也展示了巨大的潜力,例如通过基因编辑改造微生物以生产生物燃料、药物或其他有价值的化学物质。这种技术使得微生物的代谢途径可以被精确调控,从而优化产物的生成。

该文细致探讨了CRISPR-Cas9技术如何被用于微生物细胞工厂的改造,尤其是在提高代谢产物产量和改善代谢途径的应用 [6]。
5. 生物安全和环境保护
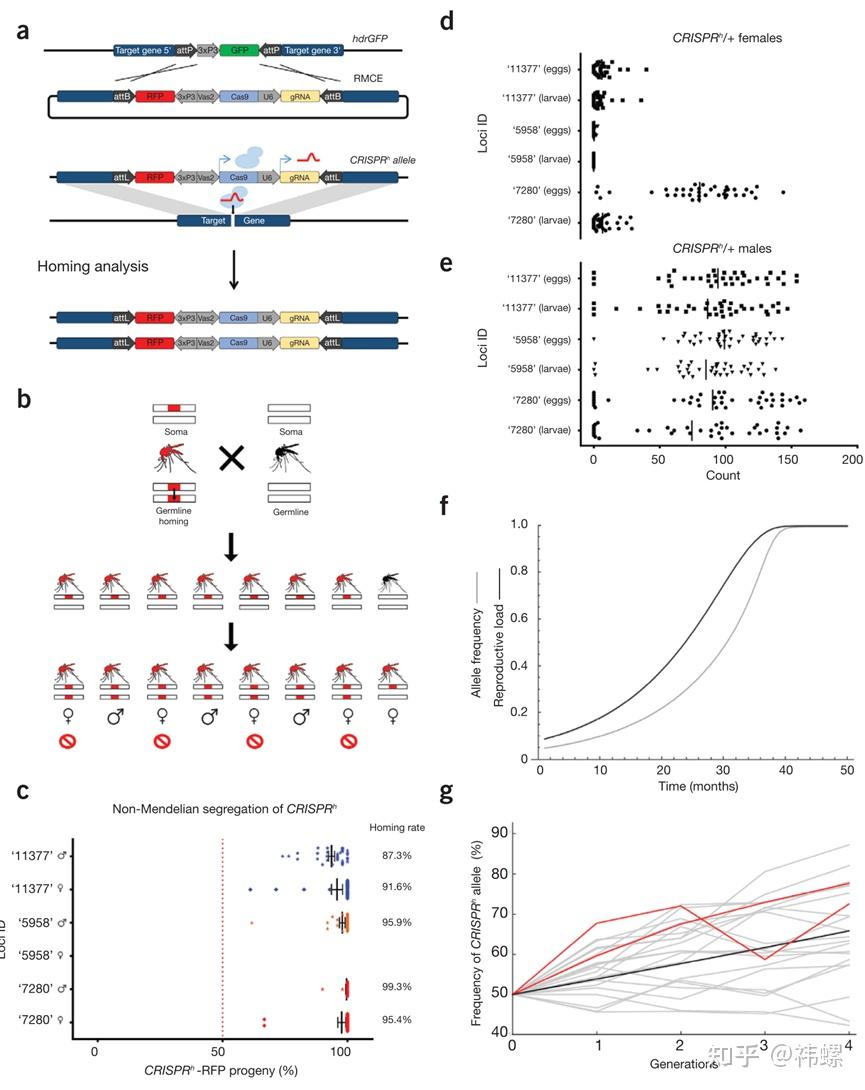
CRISPR技术也被用于生物安全和环境保护项目,如通过基因驱动(gene drive)技术控制害虫数量或治理侵入物种。此外,通过修改动物基因来控制传播疾病的昆虫或其他载体的能力,从而减少疾病的传播。

这篇文章展示了如何利用CRISPR-Cas9技术在蚊子中建立基因驱动,以控制疟疾传播 [7]。
6. 生物制剂的开发
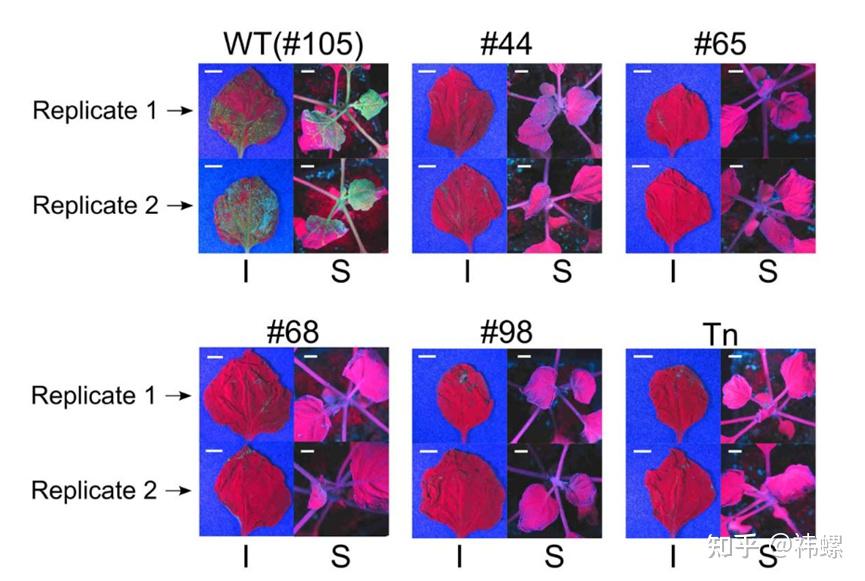
在生物制药领域,CRISPR-Cas9可以用来修改哺乳动物细胞的基因,优化药物生产过程中的蛋白质表达和修饰。这对于生产具有复杂结构的生物制剂,如抗体药物,尤为重要。

这篇研究描述了如何使用CRISPR-Cas9在烟草中引入病毒抗性,这对于生产病毒抗性的植物生物制剂具有重要意义 [8]。
CRISPR-Cas9 技术作为一种强大的基因编辑工具,已广泛应用于医学、农业和生物科学研究。通过精确修改基因,它不仅促进了遗传疾病的治疗研究,还改良了作物抗性和微生物生产能力,展示了其在科技发展中的巨大潜力和价值。希望今天的分享对你有用。
<hr/>参考文献:
[1] M. Redman, A. King, C. Watson, and D. King, “What is CRISPR / Cas9 ?,” Arch. Dis. Child. Educ. Pract. Ed., pp. 213–215, 2016, doi: 10.1136/archdischild-2016-310459.
[2] F. Jiang and J. A. Doudna, “CRISPR – Cas9 Structures and Mechanisms,” Annu. Rev. Biophys., pp. 505–529, 2017.
[3] M. Jinek, K. Chylinski, I. Fonfara, M. Hauer, J. A. Doudna, and E. Charpentier, “A Programmable Dual-RNA – Guided,” Science (80-. )., vol. 337, no. August, pp. 816–821, 2012.
[4] M. L. Maeder and C. A. Gersbach, “Genome-editing Technologies for Gene and Cell Therapy,” Mol. Ther., vol. 24, no. 3, pp. 430–446, 2016, doi: 10.1038/mt.2016.10.
[5] L. G. Lowder et al., “A CRISPR / Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation 1 [ OPEN ],” Plant Physiol., vol. 169, no. October, pp. 971–985, 2015, doi: 10.1104/pp.15.00636.
[6] M. Deaner and H. S. Alper, “Enhanced scale and scope of genome engineering and regulation using CRISPR / Cas in Saccharomyces cerevisiae CASSETTE ASSEMBLY FOR MULTIPLEXED,” FEMS Yeast Res., no. October, pp. 1–10, 2019.
[7] A. Hammond et al., “LETTERS A CRISPR-Cas9 gene drive system targeting female reproduction in the malaria mosquito vector Anopheles gambiae,” Nat. Biotechnol., vol. 34, no. 1, 2016, doi: 10.1038/nbt.3439.
[8] D. E. Pyott, E. Sheehan, and A. Molnar, “Engineering of CRISPR / Cas9-mediated potyvirus resistance in transgene-free Arabidopsis plants,” Plant Mol. Biol. Report., vol. 7, no. 20 16, pp. 1276–1288, 2016, doi: 10.1111/mpp.12417.
原文地址:https://zhuanlan.zhihu.com/p/711109392 |
|
 /3
/3 