金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
小白:江湖救急!!江湖救急!!
萌 Cece:什么事这么着急?说来听听~
小白:导师心血来潮,突然让我做 IHC 实验,完全不知道从何下手啊!!
萌 Cece:哈哈,这不巧了嘛!我刚整理了 IHC 实验操作指南,里面包含了所有操作流程和注意事项,拿走不谢~ 1 免疫组织化学(IHC)
免疫组织化学(Immunohistochemistry,IHC),一种用于检测组织切片中特定抗原或蛋白质的方法。以已知的抗体为探针,与组织或细胞中的特定抗原(如多肽、蛋白质等)进行特异性的结合。随后,利用化学反应将这些抗原-抗体复合物进行可视化,从而实现对未知抗原在组织或细胞中的定性、定位甚至定量研究。
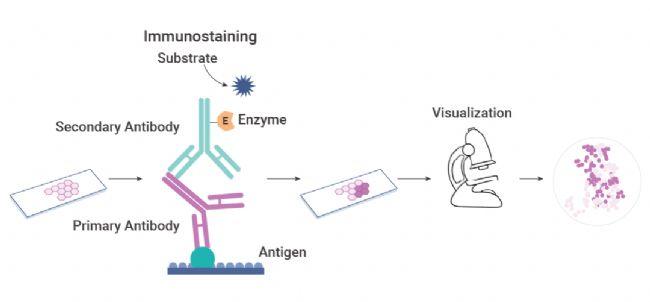
图 1. 免疫组织化学 (IHC) 原理图。
IHC 检测可分为直接法(又称一步法)和间接法(二步、三步或多步法)。直接检测方法是直接与偶联物 (例如荧光染料、酶、胶体金或生物素) 结合标记的一抗的一步过程。直接法快速,但对于检测常规处理的组织中的大多数抗原缺乏足够的灵敏度(图 2)。
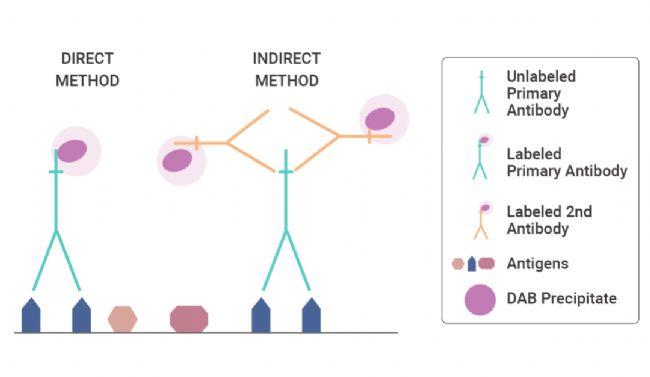
图 2. 直接和间接免疫组织化学 (IHC) 方法[1]。
为了满足灵敏度更高的抗原检测的需求,Coons 等人开发了一种两步法。第一层抗体未标记,而第二层抗体(针对一抗而产生)则被标记(图 2)。
<hr/>间接法的灵敏度高于直接法:
未标记的一抗保留了完全的亲和力,具有更强的抗原结合力,并且每分子一抗的标记物(例如过氧化物酶)数量更多,从而增加了反应强度。
- 间接法可以用较少的一抗检测较少量的抗原,用于放大一抗信号,因为一个一抗至少可以结合两个带标记的二抗。
- 间接法也比直接法更方便,因为相同的二抗可用于检测不同的一抗,前提是后者是在同一物种中产生的。
<hr/>2 IHC实验怎么做?
IHC 实验流程:通常包括样本固定、包埋、切片、脱蜡水化、抗原修复、灭活、封闭、一抗孵育、二抗孵育、显色、复染、封片观察 12 个部分。
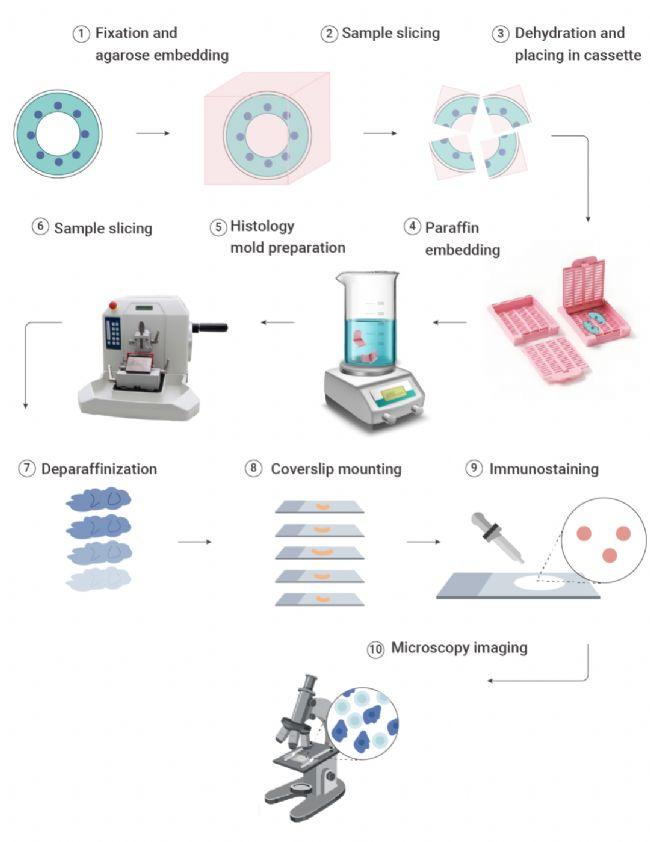
图 3. 免疫组化(IHC)流程图[2]。
2.1 样本固定
· 目的
1) 充分保存细胞成分,包括可溶性和结构性蛋白质;
2) 防止细胞成分(包括抗原和酶)自溶和置换;
3) 稳定细胞材料,避免后续程序产生有害影响;
4) 便于常规染色和免疫染色[1]。
甲醛是常规组织学和免疫组织化学固定剂的金标准。甲醛主要保存肽和细胞器的一般结构。
<hr/>· 基本步骤:
1)取材:从动物或人体取得所需的组织样本。对于组织块,要确保其大小适中,不宜过大,以便于固定液能够充分渗透。
2)初步处理:如果组织样本带有血液或其他体液,应先用生理盐水或 PBS 进行冲洗,以去除这些可能影响固定效果的物质。
3)固定:将组织样本放入固定液中。常用的固定液包括 10% 中性缓冲福尔马林 (Formalin,也称为甲醛)、甲醇、乙醇或它们的混合液等。固定液的量通常为组织体积的 10-20 倍,以确保组织能够充分浸入固定液中。大组织标本应切开固定,以免中间部分自溶解腐败。
☑ 固定时间根据组织类型和实验要求而定,一般固定时间室温 18-24 h。
4)固定后的处理:固定完成后,将组织从固定液中取出,用流水冲洗数分钟,以去除残留的固定液和可能产生的结晶。
<hr/>注意事项:
- 固定的时间不宜过长,以免导致组织过度硬化和抗原性的丧失。
- 固定的温度通常为室温或 4°C,避免高温导致组织损伤。
- 在固定过程中,要确保组织样本完全浸入固定液中,避免出现未固定的部分。
- 固定的容器应干净、无杂质,避免对组织造成污染。
<hr/>2.2 包埋
· 目的
保护和支撑组织样本,以便在切片时保持其完整性。通过将组织样本嵌入到固体介质中,可以制作出适合在显微镜下观察的薄切片。
常用的包埋介质包括石蜡、树脂等。石蜡包埋是免疫组化中最常用的方法,因为它可以有效保存组织形态,提升切片质量。树脂包埋则常用于需要更高分辨率或特殊染色方法的样本。
· 基本步骤:
1)脱水:在组织样本固定后,需要将其中的水分去除,以便于包埋介质能够充分渗透。酒精梯度脱水: 75% 乙醇、85% 乙醇、95% 乙醇、无水乙醇 (I)、无水乙醇 (II) 分别浸泡 1 min。
2)透明:脱水后,组织样本会变得不透明,需要使用透明剂(如二甲苯)来去除其中的酒精和其他溶剂,使组织样本变得透明。通常用二甲苯浸泡两次,每次浸泡 1min。
3)浸蜡:将透明后的组织样本放入熔化的石蜡中,让石蜡充分渗透到组织样本中。这个过程通常需要在温箱中进行,以确保石蜡的均匀渗透。
4)包埋:将浸蜡后的组织样本放入模具中,倒入熔化的石蜡,然后让石蜡冷却凝固。这样,组织样本就被包埋在石蜡中了。
· 注意事项:
- 在包埋过程中,要控制好温度和时间,以确保石蜡的均匀渗透和组织的完整性。
- 包埋后的组织块需要冷却凝固后才能进行切片。在冷却过程中,要避免过度冷却导致石蜡碎裂或组织变形。
- 在包埋前,要对组织样本进行充分的固定和脱水处理,以确保其抗原性和完整性。
<hr/>2.3 切片
· 目的
将包埋后的组织样本切割成薄片,以便于在显微镜下观察和检测。
· 基本步骤:
1)切片前的准备:确保包埋后的组织块已经充分冷却并固化。使用适当的切片机进行切片。
2)切片:将包埋好的组织块固定在切片机的样本夹上。调整切片机的切片厚度,通常为 4-5 微米厚,这个厚度是根据需要检测的抗原和实验要求来确定的。
3)展片:使用刷子或毛笔轻轻地将切好的组织切片从刀上取下,并放在温水 (40℃) 中展开。
4)烤片:60℃ 烤片 2 h。
· 注意事项:
- 在切片过程中,要控制好切片机的速度和切片刀的锋利度,以获得高质量的切片。
- 切片后,要及时对切片进行处理,以避免抗原的损失和组织的变性。
- 使用适当的黏贴剂,确保切片牢固地附贴在载玻片上,以便于后续的免疫组化实验。
<hr/>2.4 脱蜡水化
· 目的
将组织切片从石蜡中释放出来,并使其恢复到适合进行后续抗原检测和染色的状态。
· 基本步骤:
1)脱蜡:切片首先被置于二甲苯中浸泡,以溶解和去除切片上的石蜡。通常,这个过程会分为多个步骤,每步大约持续 5 分钟,以确保石蜡被完全去除。例如,可以使用二甲苯 Ⅰ、二甲苯 Ⅱ 和二甲苯 Ⅲ 分别浸泡 5 min。
2)水化:依次置于无水乙醇 I、无水乙醇 II,95% 乙醇、85% 乙醇和 70% 乙醇中,各浸泡 1 次,5 min/ 次;再放入纯化水中清洗浸泡 5 min。
· 注意事项:
- 彻底脱蜡:脱蜡过程必须彻底,以确保石蜡被完全去除。否则,残留的石蜡会影响后续的抗原检测和染色。
- 避免干燥:在整个脱蜡水化过程中,应确保切片始终保持在湿润的状态,避免干燥。干燥会导致非特异性抗体结合,从而出现高背景染色。
<hr/>2.5 抗原修复
· 目的
重新暴露或修正这些被封闭或扭曲的抗原,以提高免疫组化实验中的抗体与抗原的结合率,增强信号的强度和特异性[3]。
最常用的修复缓冲液是 10 mM 的 pH 6.0 枸橼酸钠、pH 9.0 的 Tris-EDTA 、pH 8.0 的 EDTA。建议测试多种方法以寻找染色效果最佳的方法。
· 抗原修复的方法:
(1) 微波热修复:加入抗原修复液,放入切片,置于微波炉中火 8 min,停火 7 min,转小火 8 min;取出染色盒,冷却至室温。
(2) 水浴热修复: 加入抗原修复液,放入切片,置于水溶锅中加热,其间不断用温度计测其温度,待抗原修复液的温度达到有效度 (92℃),维持 40 min 后取出染色盒,冷却至室温。
(3) 高压热修复: 在染色盒中加入抗原修复液,放入切片,置于高压锅内加热至饱压后继续加热 5 min,关闭电源,10 min 后取出染色盒,冷却至室温。
(4) 酶解修复:常用的消化酶有胰蛋白酶、胃蛋白酶、蛋白酶 K 等。将切片置于含有酶解液的载玻片上,然后在适当的温度和湿度条件下进行酶解 (通常为 37°C,20 min)。酶解后,同样需要冷却切片至室温再进行后续处理。
· 注意事项:
- 加热后需自然降温;
- 使用过量的抗原修复液;
- 修复液的不同 pH 值对染色结果的影响比较大;
- 没有一种抗原修复缓冲液可以适用于所有抗原。不同的抗体可能需要不同的抗原修复方法和条件,因此需要根据实验要求和抗体特性选择合适的抗原修复方法。
<hr/>2.6 灭活
· 目的
消除细胞或组织中内源性酶和活性物质的影响,降低背景噪音,提高实验的特异性和敏感性[4]。
(1) 灭活内源性过氧化物酶:HRP 检测系统,常用的去除内源性过氧化物酶的方法是 3% 过氧化氢水溶液,室温 10 min。
(2) 洗涤:用 PBS 或 TBS 等缓冲液洗涤切片、浸泡 2 次,5 min/ 次。
· 注意事项:
- H2O2 需现用现配,且 4℃ 避光保存,否则易引起非特异背景。
- H2O2 孵育时间过长也会易引起脱片。
- 部分组织还含有内源性碱性磷酸酶,可用左旋咪唑进行灭活。
<hr/>2.7 封闭
· 目的
封闭组织切片上非特异性结合位点,防止抗体与这些位点结合,从而减少背景信号。
· 基本步骤:
1)非特异位点封闭:将封闭液 (如 5% BSA 或血清等) 滴加到组织切片上,确保封闭液均匀覆盖整个组织区域。然后将切片放入湿盒中,在室温或 37°C 下孵育 30 min,让封闭液与组织切片充分作用。
2)洗涤:封闭结束后,用 PBS 或 TBS 等缓冲液洗涤切片,以去除未结合的封闭液和可能存在的杂质。
<hr/>2.8 一抗孵育
免疫组化中的一抗孵育是免疫组化实验的关键步骤之一。
· 基本步骤:
1)选择一抗:根据实验目的选择特异性高、亲和力强的一抗。一抗应该与目标抗原的种属来源、类型等相匹配。
2)稀释一抗:根据一抗的效价和实验要求,用适当的稀释液 (如 PBS、TBS 等) 稀释一抗。
3)涂覆一抗:将稀释好的一抗均匀涂覆在已封闭的组织切片上,确保抗体能够充分接触组织切片上的抗原。
4)孵育:将稀释好的一抗均匀滴加在已封闭的组织切片上,放入湿盒中,室温 (或 37°C) 孵育 1 h,使一抗与抗原充分结合。
· 注意事项:
- 确保一抗的质量和特异性,避免使用过期或质量不佳的一抗。
- 充分洗涤组织切片,去除未结合的一抗和其他杂质,减少背景染色。
<hr/>
2.9 二抗孵育
二抗的作用是与一抗结合,形成抗原-抗体-抗体复合物,从而增强信号的强度和特异性。
在免疫组化实验中,二抗通常带有标记酶(如 HRP.AP 等),这些标记物在后续的显色步骤中可以产生可见的染色信号,便于在显微镜下观察目标抗原在组织中的分布和表达情况。
· 二抗孵育的基本步骤:
1) 稀释二抗:参考二抗的说明书,按照适当比例用封闭液或其他适当的溶液稀释二抗。
2) 孵育二抗:将稀释好的二抗滴加在已经过一抗孵育并洗涤的组织切片上,室温孵育 30 min-60 min。
3) 洗涤:孵育完成后,使用洗涤液 (如 PBST 或 TBST) 在摇床上缓慢摇动洗涤切片,以去除未结合的二抗和其他杂质。洗涤通常需要重复几次,每次洗涤时间一般为 5-10 分钟。
· 注意事项:
二抗的选择和稀释比例应根据实验的具体要求和一抗的特性来确定。
对于抗体的选择还有疑惑的小伙伴可以翻翻小 M 的往期推文:官宣! MCE 迎来了一位新成员——抗体
<hr/>2.10 显色
显色检测中需要考虑的其他因素有酶和显色底物的选择。每种检测酶都有几种不同的显色剂。HRP-DAB 是最常用的显色剂组合。
原理:在免疫组化中通常使用辣根过氧化物酶(HRP)或碱性磷酸酶(AP)等作为标记酶。这些酶能催化底物发生颜色反应,从而在抗原所在的位置形成可见的沉淀物。
· 基本步骤:
1)加入酶的底物 (如 HRP 的底物为 DAB,AP 的底物为 BCIP/NBT)。
2)底物在酶的作用下发生化学反应,形成有色沉淀物,通常呈现棕色 (对于HRP-DAB 系统) 或蓝色 (对于 AP-BCIP/NBT 系统)。
3)通过显微镜观察组织切片上的颜色变化,可以确定抗原在细胞或组织中的位置和表达水平。
· 注意事项:
- 选择适当的检测系统:根据实验目的和样本特性选择合适的检测系统;
- 优化条件:对一抗、二抗的浓度、孵育时间和温度等条件进行优化,以获得最佳的检测结果。
- 注意防护:DAB 为联苯偶氨化合物,可诱发皮肤癌和膀胱症,在显色操作过程中需注意防护。
<hr/>2.11 复染
为了形成细胞轮廓,更好的定位目标蛋白,可进行复染[5]。
复染:滴加 80-100 μL 苏木素染色液至完全覆盖组织,室温孵育 5 min,自来水冲洗返蓝。
· 注意事项:
- 复染的时间是需要摸索的,这个与苏木精的配制时间有关。
- 如果染色过浅可重复染色,如果染色过深可使用盐酸进行分化。
<hr/>2.12 封片观察
在免疫组化实验中,封片观察是最后的步骤,用于保护组织切片、增强对比度和稳定性,并允许在显微镜下进行长期观察和分析。
· 封片步骤:
1)脱水:在完成所有染色步骤后,通常需要将组织切片进行脱水处理,以去除切片上的水分。切片依次使用 70%、85%、95% 乙醇、无水乙醇 I、无水乙醇 Ⅱ 分别浸泡 1 min。
2)透明:脱水后,切片需要进行透明处理,以便封片剂能够均匀分布在切片上。通常使用二甲苯浸泡两次,每次 1 min。
3)封片:将一滴封片剂 (如中性树胶、甘油明胶等) 滴在组织切片上,然后用盖玻片轻轻覆盖。封片剂的选择取决于实验要求和标本类型。封片时要确保没有气泡产生,并且盖玻片与切片之间紧密贴合。
4)干燥:让封片剂自然干燥,或者可以在温箱中加速干燥过程。干燥后的切片可以长期保存,并随时用于观察。
· 注意事项:
- 封好的切片可以长期保存,但应放置在干燥、避光、温度适宜的环境中,以避免切片受潮、褪色或损坏。
- 封片剂和某些化学试剂可能对人体有害,因此在进行封片操作时要注意安全防护措施,如佩戴手套、眼镜等。
<hr/> 3 IHC 常见问题及解决方案
Q1:染色弱?
实验过程中,我们常会遇到染色较弱的情况,如下图所示:
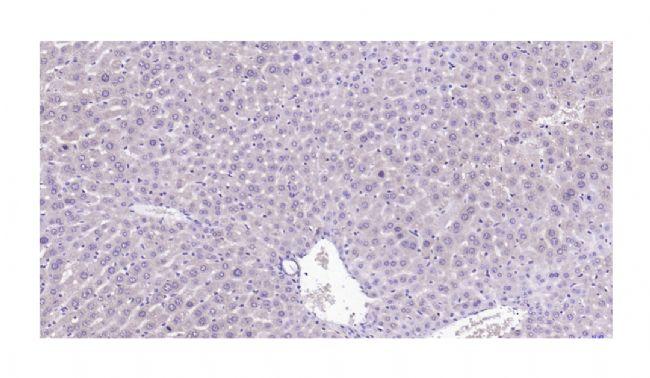
图 4. 染色弱。
可能性原因:
1)抗体浓度过低,孵育时间过短,可提高抗体浓度,延长孵育时间;
2)检查试剂是否超过有效期;
3)检查标本固定方式、抗原修复方式是否适合目标抗原;
4)未沥干切片水份,致使试剂稀释。建议滴加试剂前沥干切片中多余的缓冲液(注意防止切片干燥);
5)孵育温度过低,若室温低于 15℃,要改放在 37℃ 孵育箱孵育 30-60 min (或 4℃ 冰箱过夜)。
Q2:产生非特异性染色?
在使用检测进行诊断之前,必须了解反应在细胞或组织内的预期抗原分布。如下图所示,CD79a 抗体仅染色了浆细胞瘤细胞的细胞核。根据目前对该抗原位置(细胞质和细胞质膜) 的了解,该反应被认为不是特异性的。
注:非特异的原因也有是因为修复方式不对,可能是修复太强了。
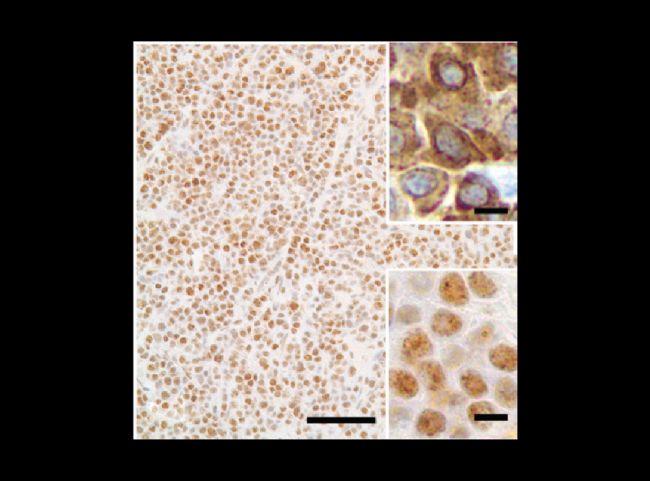
图 5. 非特异性染色[6]。
下部插图是异常染色的细节;上部插图描绘了浆细胞瘤中 CD79a 的典型细胞质染色。条 = 60 μm,两个插图条 = 5 μm。
可能性原因:
1)抗体孵育时间过长、抗体浓度高易增加背景着色。这可通过缩短一抗/二抗孵育时间、稀释抗体来控制;
2)一抗用多克隆抗体易出现非特异性着色,建议试用单克隆抗体看看;
3)内源性过氧化物酶和生物素在肝脏、肾脏等组织含量很高 (含血细胞多的组织),需要通过延长灭活时间和增加灭活剂浓度来降低背景染色;
4)非特异性组分与抗体结合,需延长封闭时间和适当增加浓度来加强封闭效果;
5)DAB 孵育时间过长或浓度过高;
6)洗涤不充分,可增加洗涤次数和洗涤时间;
7)染色过程中出现干片。干片容易导致非特异性染色,实验过程中需避免干片。
Q3:免疫组化染色呈阴性结果的原因?
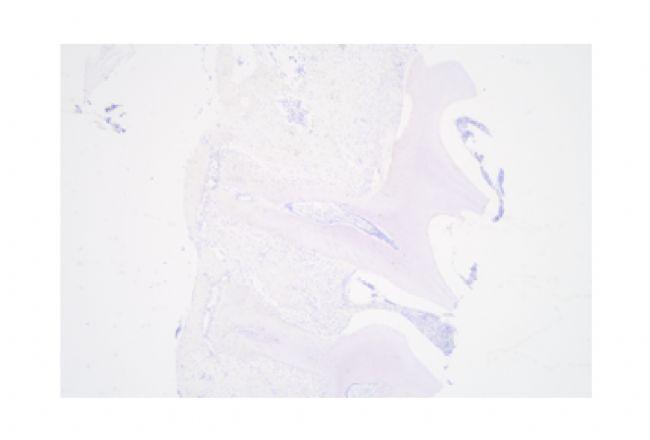
图 6. 免疫组化阴性染色。
可能性原因:
1)抗体浓度和质量问题以及抗体来源选择错误,重新确认抗体信息;
2)确认试剂是否遗漏,添加顺序是否正确;
3)抗原修复条件不合适,摸索最合适抗原修复条件;
4)组织切片本身这种抗原含量低,建议用已知阳性样本作阳性对照。
Q4:背景强?
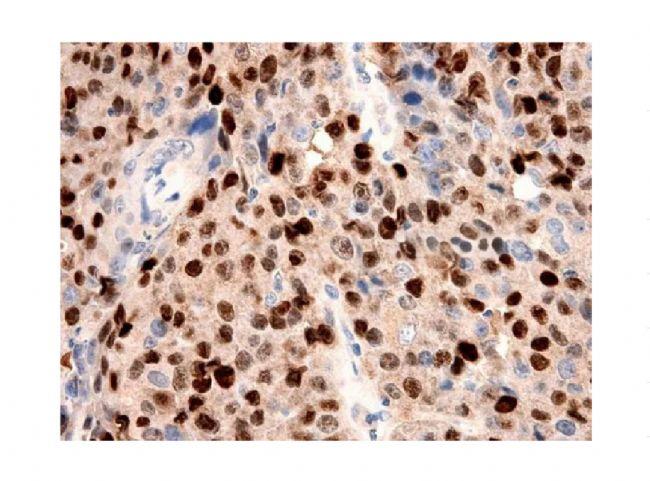
图 7. 免疫组化染色背景强。
可能性原因:
1)检查一抗和二抗浓度过高,需摸索合适的抗体浓度;
2)是否有效去除内源性酶和生物素,可延长内源性酶灭活时间;
3)血清封闭时间是否过短,可延长封闭时间;
4)检查一抗的特异性是否良好,选择特异性高的抗体;
5)适当增加抗体孵育后的洗涤次数和延长洗涤时。
<hr/>相关产品
IRF3 Antibody
IRF3 Antibody 是一个非偶联、兔源、抗 IRF3 单克隆抗体。它可用于人、小鼠背景下 WB、ICC/IF、IHC-P、FC 实验。
Ki-67 Antibody该抗体是一个非偶联、兔来源、抗 Ki-67 多克隆抗体。同时是直肠癌、宫颈癌等免疫组化检查指标之一。可用于人、小鼠、背景下的 WB, ELISA, IHC-P, IHC-F, Flow-Cyt, ICC, IF 实验
p16 Antibody该抗体是一个非偶联、兔来源、抗 p16 单克隆抗体。它是宫颈癌等免疫组化检查指标之一,可用于人背景下 WB, IHC-P 实验。
p53 Antibody该抗体是一个非偶联、兔源、抗 p53 单克隆抗体。它可用于人背景下 WB、ICC/IF、IHC-P、IP 实验。
HRP-conjugated AffiniPure Goat Anti-Mouse IgG H&L该抗体是偶联了 HRP 标记、山羊来源的抗小鼠 IgG 抗体。它可结合小鼠 IgG 抗体的轻链和重链,用于小鼠背景下 WB、ELISA、IHC 实验。
HRP-conjugated AffiniPure Goat Anti-Rabbit IgG H&L
该抗体是偶联了 HRP 标记、山羊来源的抗兔 IgG 抗体。它可结合兔 IgG 抗体的轻链和重链,用于兔子背景下 WB、IHC-P、ELISA 实验
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
<hr/>参考文献:
[1] Ramos-Vara JA,et al. When Tissue Antigens and Antibodies Get Along: Revisiting the Technical Aspects of Immunohistochemistry—The Red, Brown, and Blue Technique. Veterinary Pathology. 2014;51(1):42-87.
[2] Amereh M,et al.Immunohistochemistry (IHC) staining of in-vitro cancer cell-generated tumoroids. MethodsX. 2023 Jun 3;10:102242.
[3] Shi SR,et al.Antigen retrieval in formalin-fixed, paraffin-embedded tissues: an enhancement method for immunohistochemical staining based on microwave oven heating of tissue sections. J Histochem Cytochem. 1991 Jun;39(6):741-8.
[4] Hussaini HM,et al.Immunohistochemistry and Immunofluorescence. Methods Mol Biol. 2023;2588:439-450.
[5] Mebratie DY,et al.Review of immunohistochemistry techniques: Applications, current status, and future perspectives. Semin Diagn Pathol. 2024 May;41(3):154-160.
[6] Ramos-Vara JA, et al. Suggested Guidelines for Immunohistochemical Techniques in Veterinary Diagnostic Laboratories. Journal of Veterinary Diagnostic Investigation. 2008;20(4):393-413. |
|
 /3
/3 