金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
在网络上找到了一篇应用:
蛋白质的蛋白印迹检测法简介
引言
核酸与蛋白质等大分子向固相支撑膜的转移称为印迹。在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)上分离的蛋白质,在电流作用下,被转印到由硝酸纤维素或聚偏二氟乙烯(PVDF)制成的膜上,这一过程称为西方蛋白印迹法, 亦称为蛋白印迹或免疫印迹。该技术是研究细胞或组织提取物样品中蛋白质的有力工具。该方法包括以下5个主要步骤:
样品制备
该步骤包括从细胞或组织中提取蛋白质,并估算蛋白质浓度。含有去垢剂、蛋白酶和磷酸酶抑制剂的各种裂解缓冲液可用于溶解来自全组织或组织培养物提取物的蛋白质。样品中的总蛋白质可以用Bradford试剂通过分光光度法在595 nm处定量。
凝胶电泳
基于等电点、分子量、电荷或所有这些的组合来分离蛋白质。最常用的方法是使用载有SDS的聚丙烯酰胺凝胶进行电泳(SDS-PAGE)。用还原剂煮沸使蛋白质样品变性以在电泳之前破坏二硫键。
转印蛋白质
通过电泳在凝胶上分离的蛋白质,被转移和固定至固体支撑物(例如PVDF或硝酸纤维素膜)上。转印过程就是,在电流作用下,蛋白质被从凝胶中拉到膜上(电印迹)。了解新的SNAP i.d.® 2.0印迹滚筒和其他配件。
验证蛋白质
为了检测转印到膜上的靶蛋白,重要的是阻止检测任何非特异性蛋白,以免造成假阳性结果。这通常使用阻断剂来完成,例如BSA、脱脂乳或特异性抗血清。之后,将膜与优化浓度的对靶蛋白特异的一抗和二抗一起孵育。
检测及可视化
可以用比色、射线、化学发光或荧光法检测感兴趣的蛋白质。二抗通常与辣根过氧化物酶连接,并切割化学发光剂。反应产物所产生的光被照相胶片检测,其强度指出了靶蛋白的含量。

样品制备
提取蛋白质
从(新鲜或冷冻)细胞或组织中提取蛋白质的所有步骤必须在2-8°C下进行。以下是用于制备蛋白质样品的裂解缓冲液的成分。
RIPA缓冲液
NaCl (S3014) 150 mM
Triton X-100 (T8787) 1%
0.5%脱氧胆酸钠
0.1% SDS (L3771)
50 mM Tris-HCl pH 8.0
蛋白酶抑制剂
从贴壁细胞提取蛋白质
- 将含有细胞的培养皿中的培养基丢弃,用冰冷的PBS洗涤细胞。
- 丢弃PBS,加入冰冷的裂解缓冲液。
- 使用冷塑料细胞刮刀刮擦细胞。收集微量离心管中的细胞。
- 将微量离心管中的内容物在4℃下搅拌30分钟。
- 将离心管在4℃下以16000G离心20分钟。将上清液收集在新管中并置于冰上。丢弃沉淀物。
从细胞悬液提取蛋白质
- 将细胞悬液在4℃下以2000G离心5-7分钟。细胞将聚集于试管底部,弃去上清液。
- 向细胞沉淀中加入冰冷的PBS,并在4℃下以2000G离心5-7分钟洗涤细胞。
- 向细胞沉淀中加入冰冷的裂解缓冲液。将微量离心管中的内容物在4℃下搅拌30分钟。
- 将离心管在4℃下以16000G离心20分钟。将上清液收集在新管中并置于冰上。丢弃沉淀物。
从组织中提取蛋白质
- 在冰上切割要研究的组织。将组织转移到圆底离心管,浸入液氮快速冷冻。
- 对于5 mg组织,加入300 μL冰冷的裂解缓冲液,使用电动匀浆器均化。在均质化过程中另再添加300-600 μL裂解缓冲液。
- 在4℃下搅拌内容物2小时。
- 将离心管在4℃下以16000G离心20分钟。将上清液收集在新管中并置于冰上。丢弃沉淀物。
估算蛋白质
- 取少量裂解物进行蛋白质估算测定。
- 可以使用考马斯蛋白质测定试剂 (27813) 估算蛋白质。
- 记录595 nm处标准品和未知样品的吸光度。
- 通过与标准品比较确定未知样品的蛋白质浓度。
- 将适当体积的裂解物转移到微量离心管中,使得所有样品都含有相同的总蛋白质浓度。
- 加入足够的冰冷裂解缓冲液,使所有裂解物具有相同的体积。
样品制备
以下是制备电泳样品所需的上样缓冲液的成分。
2X Laemmli上样缓冲液
溴苯酚蓝 (B5525) 0.004%
2-巯基乙醇,10%
甘油 (G5516) 20%
SDS (L3771) 4%
Tris-HCl 0.125 M
- 向一定量的细胞裂解物中加入等量的上样缓冲液。
- 将上述混合物在95℃下煮沸5分钟。以16000G离心5分钟。
- 这些样品可以在-20℃下储存,也可以用于进行凝胶电泳。
凝胶电泳
可从Sigma-Aldrich获得用作阳极和阴极缓冲液的运行缓冲液(GE28-9902-52)。另外也可以用各种组分制备运行缓冲液。
10X 凝胶运行缓冲液,pH ~8.6
Tris 250 mM
甘胺酸 (G8898) 1.92 M
SDS (L3771) 1%
- 将等量的蛋白质加入含有层积胶和分离胶的不连续的预制凝胶中。
- 如果需要,包含蛋白质标记物。
- 在80-100 V下运行层积胶,当样品进入分离胶后,将电压增加至100-150 V,直到溴苯酚蓝染料前端到达凝胶末端。
凝胶染色
R-PROB染色
- 将电泳后的凝胶浸入固定溶液中20分钟。重复此步骤两次。
- 在水中冲洗凝胶两次,每次冲洗持续30分钟。
- 将凝胶在用于膜和聚丙烯酰胺凝胶的可逆蛋白质检测试剂盒(RPROB)中孵育20-40分钟,同时轻轻搅拌。
- 用10%乙酸洗去多余的染色剂。
- 脱色:用EDTA洗涤凝胶,然后在水中或定影液中洗涤15分钟,洗两次。
铜染色
- 为了确认蛋白质的迁移和分离,凝胶可以用可逆染色剂(如CuCl2)染色。
- 将电泳后的凝胶用蒸馏水冲洗最多30分钟。
- 将凝胶浸入0.3 M CuCl2溶液中10分钟,然后用去离子水短暂冲洗。
- 蛋白质可以在蓝色背景上显示为清晰的区域。如果需要,拍摄凝胶。
- 脱色:反复在0.25 M Tris和0.25 M EDTA溶液(pH 9)中洗涤染色的凝胶。
- 在进行后续的转印操作之前,将脱色后的凝胶转移至转印缓冲液中。
转印蛋白质
电印迹可以在湿的或半干条件下进行。在两种程序中,所需的主要设备是转印缓冲液和转印装置。
试剂
1X转印缓冲液(从10X转印缓冲液,T4904制备)
甲醇 (M1775)
PVDF (05317, Z671061, GERPN1416) 或硝酸纤维素 (Z613630, Z613886) 膜
在准备转印设置之前,需要对PVDF膜按以下步骤平衡:
- 切割适当尺寸的PVDF膜。
- 将膜在甲醇中浸泡2分钟。
- 去除甲醇,将膜在冷的转印缓冲液中孵育5分钟。
- 现在PVDF膜已平衡完毕,可以用于转印蛋白质。
请勿在甲醇中孵育硝酸纤维素膜。在转印缓冲液中孵育就足够了。
为了将从凝胶中分离的蛋白质转印到膜上,必须在印迹装置中准备转印堆叠层。确保凝胶与膜之间没有气泡。
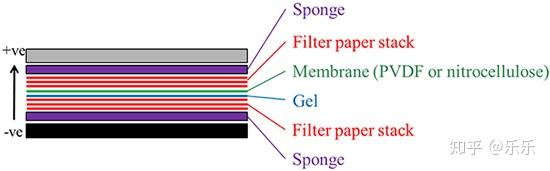
图3:蛋白印迹转印组件
Sigma-Aldrich提供半干印迹单元,可保持缓冲容积,生热少,带的扭曲小,并允许不同厚度的多层凝胶转印。
转印可以在50V的电压下在4℃进行2小时。
蛋白质检测的印膜可逆染色
蛋白质从凝胶转印到膜后,可以对膜进行可逆染色(如Ponceau S)加以确认。以下是膜的可逆染色所需的试剂。
操作步骤
- 在TBST中清洗膜(如果膜在转印后已经风干,则应将膜浸入TBST直至其再次完全润湿)。
- 将膜浸入染色溶液中5分钟,这时在膜上可以看到红色 / 粉色蛋白质条带。
- 如要脱色,将膜浸入0.1 M NaOH中,蛋白质条带在约30秒后开始消失。
- 用流动的蒸馏水冲洗膜2-3分钟。
- 完全脱色的膜现在适合用抗体进行蛋白质验证。
蛋白质验证
封膜
封膜溶液
Sigma-Aldrich提供易于使用的封膜溶液:W0138、T8793、B6429和C7594。
也可以使用脱脂奶粉的3%的TBST缓冲液,或者溶于TBST缓冲液的5% BSA(A7906)。
- 如果正在制备封膜溶液,请过滤溶液,以避免在显影过程中印迹上出现深色颗粒背景。在检测磷酸化蛋白质时最好使用含有BSA的封膜溶液。
- 在4°C下在封膜溶液中封膜1小时。封膜时间必须根据抗体使用的蛋白质加以优化。
- 在与封膜溶液一起孵育后,在TBST中洗涤膜1分钟。
在一抗中孵育
- 按照数据表中的建议在TBST中稀释一抗。有些抗体是用BSA的5%的TBST溶液稀释。
- 在4℃下,将膜在一抗溶液中孵育数小时至过夜。建议在抗体溶液中孵育膜时摇动,这有助于均匀结合。
- 孵育后,去除一抗溶液。用TBST洗涤膜三次,每次洗涤5分钟。
在二抗中孵育
最常用的二抗是与辣根过氧化物酶(HRP)或碱性磷酸酶(ALP)缀合。与后者相比,HRP缀合的二抗更敏感。
- 按照数据表中的建议在TBST中稀释二抗。
- 在室温下将膜在二抗溶液中孵育1-2小时,期间搅拌。
- 孵育后,去除二抗溶液。用TBST洗涤膜三次,每次洗涤5分钟。
检测
此处有使用蛋白印迹检测蛋白质的各种方法。
参考文献
- Sambrook, J., Fritsch, E.F., and Maniatis, T., Molecular cloning: a laboratory manual. New York: Cold spring harbor laboratory press, 1989.
|
|
 /3
/3 