登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
阿尔兹海默症(AD)一种以进行性认知功能障碍和行为损害为特征的中枢神经系统退行性病变,目前其病因和发病机制尚不明确。β淀粉样蛋白(Aβ)级联假说是目前AD的发病机制中最经典的学说,该假说认为老年斑中过度沉积的Aβ是导至AD病理生理改变的始动因素,tau蛋白的过度磷酸化、神经元丢失,突触损伤等病理改变是由Aβ沉积引起的一系列级联反应。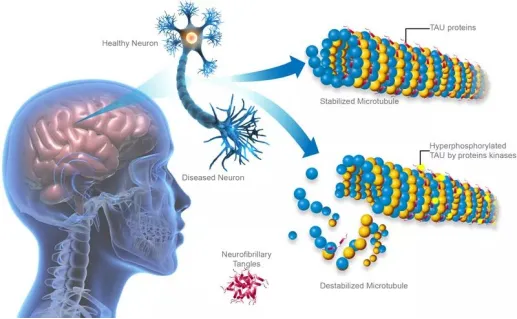 [color=rgba(0, 0, 0, 0.9)]DOI: 10.1126/sciadv.aaw6404
7月10日,利兹大学的研究团队在Nature发表了一篇题为“CryoET of β-amyloid and tau within postmortem Alzheimer’s disease brain”的文章。该研究团队通过冷冻电子断层扫描技术(CryoET)成功绘制出大脑内蛋白质的三维分布图,直观展示了β-淀粉样蛋白与Tau蛋白在发病人脑中的复杂形态。  为了探究发病患者脑内β-淀粉样蛋白与Tau蛋白的变化,作者使用了带荧光(MX04)的抗体来标记蛋白,通过cyto-CLEM成像定位Aβ和tau的位置。这也是首次对AD患者脑内Aβ和tau进行的原位成像研究。分析样本来自一位70岁的女性AD患者,在患者死后约6小时取脑样本经液氮急冻保存。后解冻再高压-188℃急冻,制备成70nm的薄片进行cyto-CLEM成像。 为了探究发病患者脑内β-淀粉样蛋白与Tau蛋白的变化,作者使用了带荧光(MX04)的抗体来标记蛋白,通过cyto-CLEM成像定位Aβ和tau的位置。这也是首次对AD患者脑内Aβ和tau进行的原位成像研究。分析样本来自一位70岁的女性AD患者,在患者死后约6小时取脑样本经液氮急冻保存。后解冻再高压-188℃急冻,制备成70nm的薄片进行cyto-CLEM成像。[color=rgba(0, 0, 0, 0.9)]病理切片结果显示有大量的淀粉样斑块、tau缠结、tau丝和少量的穿过颞中回的脑淀粉样血管病血管。免疫组织化学和生物化学特征鉴定为AD并排除其他常见神经退行性疾病的可能。  (a)死后阿尔茨海默病(AD)捐赠者中Aβ/APP病理的免疫组织化学检测;(b)WB检测检测tau 46;(c)在AD死后捐赠者大脑中使用荧光共聚焦显微镜检测(从左至右)淀粉样蛋白(MX04)、Aβ/APP(4G8)、磷酸化Tau(AT8)以及它们的合并图像;(d)冷冻光电联用技术流程图;(e)AD死后大脑活检组织的高压冷冻固定冷冻荧光显微镜图像;(f)tau缠结和缠结丝;(g)MX04标记的β-淀粉样蛋白斑块扫描电镜可观察到Aβ原纤维结构在斑块内形成平行阵列或晶格结构,与此前在FAD小鼠模型中观察到的一致。Aβ斑块与各种膜结合的亚细胞区室和相关的大分子成分相互交错,包括细胞外囊泡、细胞外液滴、70-200 nm立方体颗粒和膜碎片。其中立方体颗粒和膜碎片并未在FAD小鼠模型的脑组织切片中观察到。膜碎片可能是PMI和冻融过程中产生的,而细胞外立方体颗粒的结构与载脂蛋白E(ApoE)和前黑色素体蛋白相关腔内囊泡的立方体滴状结构相似,因此猜测可能是某种脂蛋白。 (a)死后阿尔茨海默病(AD)捐赠者中Aβ/APP病理的免疫组织化学检测;(b)WB检测检测tau 46;(c)在AD死后捐赠者大脑中使用荧光共聚焦显微镜检测(从左至右)淀粉样蛋白(MX04)、Aβ/APP(4G8)、磷酸化Tau(AT8)以及它们的合并图像;(d)冷冻光电联用技术流程图;(e)AD死后大脑活检组织的高压冷冻固定冷冻荧光显微镜图像;(f)tau缠结和缠结丝;(g)MX04标记的β-淀粉样蛋白斑块扫描电镜可观察到Aβ原纤维结构在斑块内形成平行阵列或晶格结构,与此前在FAD小鼠模型中观察到的一致。Aβ斑块与各种膜结合的亚细胞区室和相关的大分子成分相互交错,包括细胞外囊泡、细胞外液滴、70-200 nm立方体颗粒和膜碎片。其中立方体颗粒和膜碎片并未在FAD小鼠模型的脑组织切片中观察到。膜碎片可能是PMI和冻融过程中产生的,而细胞外立方体颗粒的结构与载脂蛋白E(ApoE)和前黑色素体蛋白相关腔内囊泡的立方体滴状结构相似,因此猜测可能是某种脂蛋白。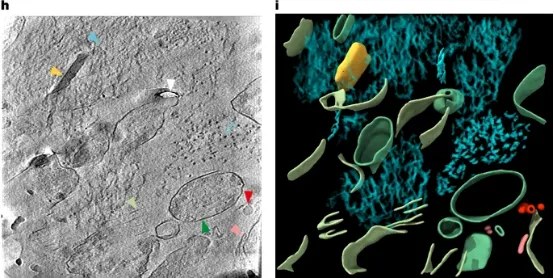 [color=rgba(0, 0, 0, 0.9)](h)β-淀粉样蛋白断层切片:青色箭头:原纤维;黄色箭头:细胞外立方颗粒;红色箭头:细胞外液滴;粉红色箭头:细胞外囊泡;深绿色箭头:亚细胞室;浅绿色箭头:质膜室破裂;白色箭头:刀损伤(i)3D重建 [color=rgba(0, 0, 0, 0.9)]tau蛋白以300-800nm的平行簇状排列的细丝形式存在,位于神经突起和髓鞘化轴突的细胞质内以及细胞外。胞外tau蛋白簇位于髓鞘化轴突外一个受损的线粒体旁边,且附近没有发现包裹它们的质膜。由此作者猜测tau蛋白沉积可能与线粒体损伤有关。 [color=rgba(0, 0, 0, 0.9)] 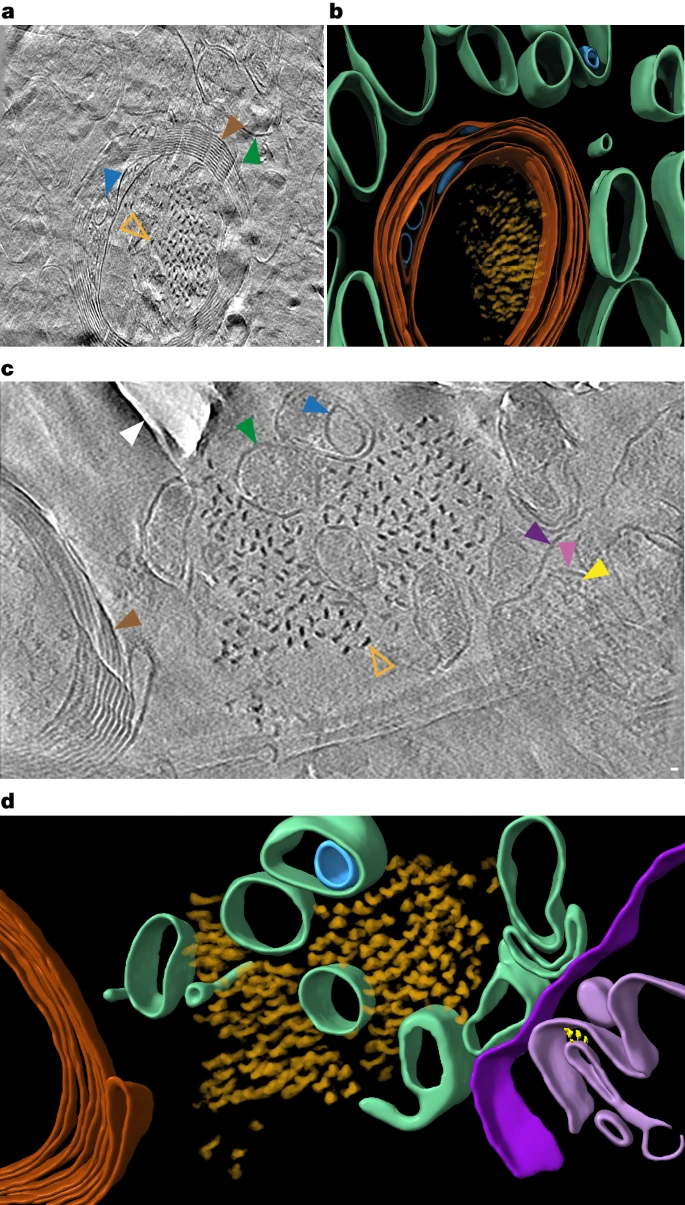 [color=rgba(0, 0, 0, 0.9)](h)tau蛋白断层切片:橙色:tau细丝;棕色:髓鞘轴突;绿色:亚细胞区室;蓝色:细胞内膜结合的细胞器 (b)3D重建 先前的研究表明,AD中的tau细丝具有成对的螺旋细丝与直细丝两种形态。本研究进一步发现,相同形态的细丝更倾向于彼此邻近排列。作者推测可能是tau细丝间存在的极性相互作用,促使它们形成了非随机的空间排布。
相比之下,由于Aβ细丝较小,可能缺乏足够的相互作用面或强度来达成类似的有序排列。 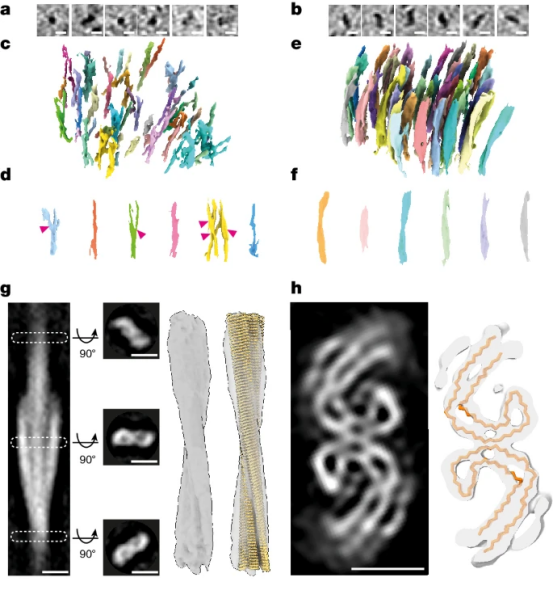 [color=rgba(0, 0, 0, 0.9)](左)β-淀粉样蛋白原纤维和(右)tau细丝的组织内结构 作者最后表示,这篇文章进行的原位结构探索流程可以应用于更大规模、具有多样性的AD捐赠者群体,用于研究不同的脑区和AD的早期阶段,分析在不同结构中的淀粉样蛋白空间组织与个体神经病理特征之间的关系。此外,该方法也可以应用于其他神经退行性疾病,如帕金森病、亨廷顿氏病等。虽然这些疾病的病理表现和发病机制各不相同,但它们在淀粉样蛋白沉积方面可能存在共性或重叠。将原位结构工作流程应用于这些疾病,可以揭示它们之间在淀粉样蛋白沉积方面的相似性和差异性,为跨疾病研究提供新的视角。文章来源:https://doi.org/10.1038/s41586-024-07680-x
|  /3
/3 