金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
流式细胞术是非常让人着迷的实验——高速客观、结果稳定、具有统计学意义,能够处理复杂样本并同时获取多种参数。我们经常在文献中看到这种类型的图表,它是流量分析图表,美观,简单,一目了然。
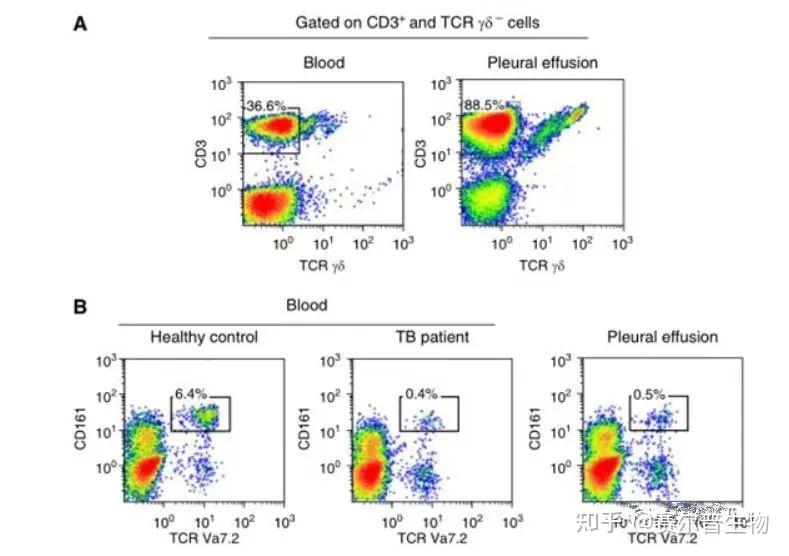
流式细胞术是20世纪60年代末发展起来的一项新技术,它利用流式细胞术快速定量地分析细胞群的物理和化学特性,并根据这些物理和化学特性准确地选择细胞。
这篇给大家整理了我们自己的流式实验经验——流式细胞术从「实验设计」到「结果分析」的超全流程 protocol,在此先求个点赞+收藏+喜爱三连!
<hr/>生物实验方案与实验操作学习视频↓↓↓
链接:https://pan.baidu.com/s/1IzCMrKocM7RdXiOtlq5Yiw?pwd=eety
提取码:eety
<hr/>01.实验设计>>
实验设计设计多色流式实验时,有2个关键的步骤
1.了解仪器配置
了解哪些荧光染料可以使用,哪些不可以使用;
2.了解生物标志物
列岀感兴趣的标志物,并对其在细胞中的表达丰度和分布有一个总体的了解;
流式细胞仪通常配有多个激光器,它们产生特定波长的光。由于每种荧光染料发出的光通常结合长通或短通滤光片被带通滤光片过滤,故流式细胞仪只检测特定波长范围内的荧光。在选择荧光染料时,请确认仪器带有能够激发目标荧光染料的激光器,以及能够检测该染料发射光的滤光片组合。 <hr/>02.抗体选择/多色组合设计>>
一般来说,在同一样品上使用的荧光染料越多,从该样品中收集到的信息也越多。在单个样品上组合使用多种荧光染料时,设计需要遵循以下几点基本建议:
<10种颜色
1.抗原密度*应该与荧光染料亮度相匹配
最重要的是,低密度或难以检测的标志物应该与明亮的荧光染料配对。
高密度的标志物与中等或暗淡的荧光染料配对。 2.选择跨通道的荧光染料,最大限度减少荧光溢漏。
3.测试!
>10种颜色
1.让低表达丰度的标志物与明亮的荧光染料相匹配。
2.最大限度减少溢漏,特别是低表达抗原。
3.利用溢漏扩散矩阵(SSM)**来确定哪些通道的分辨率可能受到影响。
4.对于相互排斥的抗原(同一类细胞上不会同时表达的抗原),将次优的荧光染料组合留给它们。
5.测试!
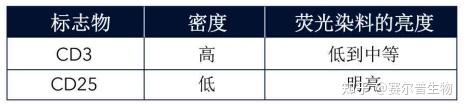
<hr/>什么是抗原密度?
抗原密度指的是蛋白质在细胞内或细胞上的表达水平(详见下图),这是在多色设计时的一个重要考虑因素。为了确保能被检测到,低水平表达的抗原、细胞内抗原或连续表达(非诱导)的抗原应当与最明亮的荧光染料配对。抗原密度和预期表达模式可在网上或文献中查到。
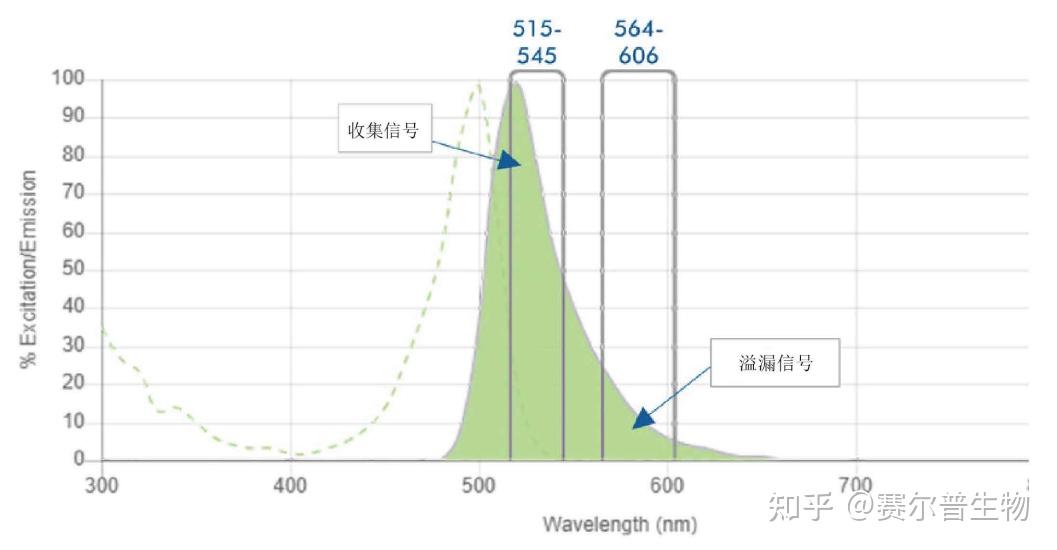
溢漏与溢漏扩散之间有何差异?
溢漏是指荧光染料的信号“溢出”到其他的检测器。这是由荧光染料发射和仪器光学设置产生的问题。如下图所示,绿色信号(AF488)除在FITC滤光片(515-545nm)中检测到。也在邻近的PE滤光片(564-606nm)中检测到。这种溢漏可通过补偿来校正。
溢漏扩散是因多个荧光染料溢出到每个检测器而导致的测量误差,这引起某些通道的分辨率降低。
随着实验中荧光染料的数量不断增加,溢漏扩散变得影响更大,并且荧光越亮,扩散越大。通过建立溢漏扩散矩阵(SSM)可识别哪些通道可能出现溢漏扩散的问题。一般来说应避免暗淡信号受到这种现象的影响。
在下图的例子中,2号检测器的荧光扩散到1号检测器,随着2号检测器的信号增强,扩散也增大。因此,如果要分析1号检测器中的低表达抗原(浅灰色圆圈)和2号检测器中的高表达抗原(橙色),低表达抗原的检测会受到影响。

<hr/>实验对照
流式细胞术的对照可分为5大类:
1)仪器对照
仪器对照是通过追踪激光器、检测器和流体性能,从而确认仪器是否正常工作3。一般来说,这些对照涉及到仪器制造商提供或出售的校准颗粒或荧光微球。这些质量控制微球应在仪器运行的每一天使用。
2)补偿对照
当荧光染料之间的发射光谱重叠时,这些信号会扩散到多个通道。校正溢漏的过程被称为补偿4。补偿可确保检测器只计算该通道特定的荧光发射光(图1)。补偿实验需要每种荧光染料的单染样品(每个样品只染一种染料)。这些可以利用细胞、补偿微球或抗体捕获微球*来设置。在创建补偿对照时,请注意四个基本原则:
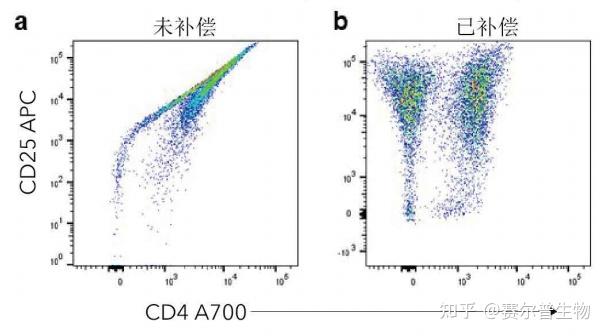
图1 未补偿vs.补偿的数据。利用CD3/CD28抗体刺激人CD3+T细胞7天。利用hCD4A700抗体(R&DSystems货号FAB3791N)和hCD25APC抗体(R&DSystems货号FAB1020A)对细胞进行染色。图中显示了未补偿(a)和补偿(b)的hCD4和hCD25的散点图。
①补偿荧光染料必须与实验荧光染料完全匹配。
◆同一通道内的荧光染料仍具有不同的发射光谱,并且不可互换。例如,FITC不能作为GFP的补偿对照。
◆由于复合染料的差异,实验中的复合染料标记抗体应当与补偿计算所用的抗体完全相同(来自同一支抗体)。使用相同的复合荧光染料偶联不同的抗体、甚至仅是不同批次抗体,都可能会导致计算结果不准确。
②补对照的亮度必须与实验样品相同或更高。
③对于任何对照,阴性和阳性群体的自发荧光必须相同。最好的做法是单独为每个通道的阳性和阴性群设门,避免使用通用的阴性对照。
④收集足够多的事件!补偿依赖于荧光强度中位值的准确计算,如果事件太少,将无法准确计算。收集数量应多于5000个。
抗体捕获微球与抗体重链结合,因此与生物样品不同,不需要特异性抗原识别。作为实用性补偿试剂,这些微球可提高补偿的一致性,特别适用于:
●阳性群体染色暗淡或稀少。补偿微球具有强烈的荧光信号,使得补偿对照的亮度与实 验样品相同或更高
●处理多种荧光染料
●样品数量有限
<hr/>3)设门对照
在分析流式细胞术的数据时,最关键的是正确设门。当细胞群体无法清晰界定或比较稀少时,需要荧光减一对照(FluorescenceMinus One,FMO)来解释流式数据并准确设门。FMO对照能够在多色实验中可靠评估背景,故它们能准确区分阴性和阳性细胞群体。
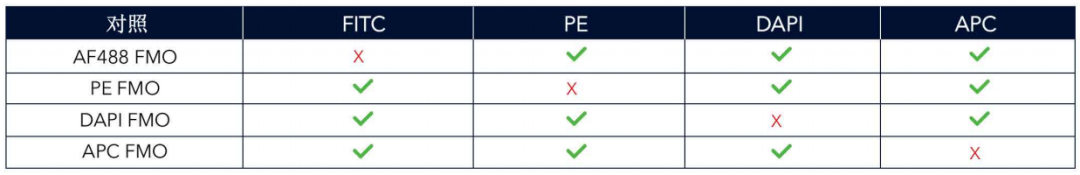
制备FMO对照是用所有荧光抗体染色细胞,但去掉某一种荧光抗体。例如,如果利用AF488、PE、APC和DAPI开展四色实验,那么FMO对照可按照下表来设置:
4)特异性染色体对照
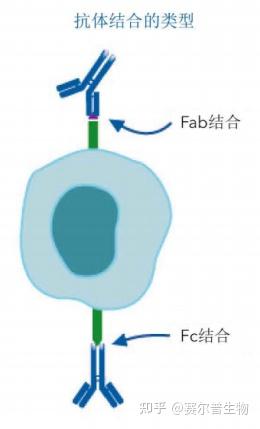
抗体与细胞结合有三种基本形式:
a.Fab区域与抗原结合(理想情况)
b.Fc区域与Fc受体结合(通常不想要)
c.非特异性结合(脱靶抗原、“粘”住细胞膜等)
在各种流式细胞术分析中,避免非特异性结合的最佳方法有:
a.正确滴定所有的试剂
b.封闭细胞的Fc受体
c.加入一种细胞活性染料以排除死细胞
▶ 什么是同型对照?
同型对照可用于评估因抗体类别引起的非特异性结合。同型对照是指与一抗的类别、亚型和荧光标记物一致但对目标靶点无特异性结合的抗体。通过检测背景染色,同型对照可以指示实验步骤是否需要进一步优化。同型对照可用于确定:
◆细胞是否充分封闭:如果未完全封闭,同型对照将与Fc受体结合。如果非特异性结合的原因在于细胞存在“粘性”,特别是死细胞的存在,则可在染色液中加入DNA酶。
◆胞内指标染色期间是否充分洗涤:针对细胞内靶标的抗体即使不与抗原结合,也常常会出现被拦在细胞内。
同型对照一直是流式细胞术中最常用的阴性对照之一。但是,完全匹配的同型对照必须与待测抗体有着相同的免疫球蛋白重链和轻链,而且荧光染料与抗体的偶联比例也相同。在同型对照不满足这些要求的情况下,用户必须小心背景染色的过度解读2,5。对于多色流式组合,同型对照无法解释其他通道中的试剂所引起的背景荧光。FMO对照可以用来评估这种背景信号。
▶ 什么是同抗对照
同抗对照(Isoclonic)是指添加过量的未标记抗体,以检测非特异性结合。如果抗体是特异性的,那么过量的未标记抗体将导致荧光强度的降低。荧光若没有减少,则表明非特异性结合的存在。
<hr/>5)实验对照
实验对照分为几个主要类别:
•生物学阴性对照用于提供所有待测标志物的表达背景。在比较细胞经过化学或生物学处理后的蛋白质表达差异时,这种对照特别重要(图2)。
•生物学阳性对照用于证实抗体在相关细胞中的阳性染色,以表明抗体在实验中起作用。
•纵向对照/参考对照是长期研究的质量控制,可以确保实验过程中的染色一致性。
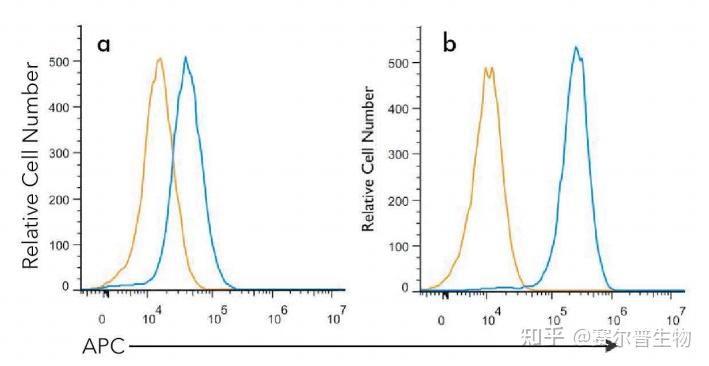
图2.诱导标志物的阴性对照。Jurkat细胞未经处理(a),或经过50uM氯喹(TocrisBioscience货号4109)处理24小时(b)。利用LC3B(1251A)抗体(NovusBiologicals货号NBP2-46892,蓝色)和匹配的同型对照(R&DSystems货号MAB1050,橙色)进行细胞内染色。用4%甲醛固定细胞,之后用0.1%皂苷透化细胞。与1ug/mL的抗体室
<hr/>02.样本制备
各种来源的样品准备进行流式分析时需制备成单颗粒悬液,以分析活细胞或固定细胞、细胞核、微生物或小颗粒,具体取决于分析目标。拥有或开发一个好的样品制备方案,将为实验成功打下基础。在制备单细胞悬液时,主要的考虑因素是尽量减少细胞死亡和碎片。死细胞导致样品中岀现团块,这些团块往往在免疫染色中粘附游离的抗体,且表现岀更高水平的自发荧光,从而干扰荧光的准确测定。制备过程中的碎片过多则会提高噪音水平,如果过量还会干扰目标细胞的测定。
尽管流式细胞术没有神奇的诀窍(岀自HowardShapiro的流式细胞术第零定律),样品制备是可以通过以下步骤来优化:
1.获得并保持单细胞悬液。
1)过滤器是从样品中去除团块的好工具。建议从40μm过滤器开始。
2)某些染色液添加剂可减少细胞成团。
a.EDTA(~1-5mM)可减少阳离子依赖性细胞粘附。
b.DNA酶(~0.1mg/mL)能降解死细胞的DNA,并减少细胞粘附。
3)从整个组织中获得细胞群体可能颇具挑战性。通常用胶原酶和胰蛋白酶来分解组织和解离细胞。避免过度消化,这会破坏目标抗原表位或影响细胞活力。
2.了解生物样品并保持细胞活力,细胞制备的标准方案将取决于细胞来源。
1)将细胞置于冰上并使用预冷的缓冲液,有助于维持某些细胞的活力。(注意:这未必适用于所有细胞或所有应用!)
2)尽量减少处理时间、涡旋振荡、离心速度及次数,所有这些都会影响细胞活力。例如,外周血、淋巴组织和培养细胞在制备单细胞悬液时不要使用剧烈的处理方法。
3)在固定之前,尽可能快地处理细胞,以便减少实验假象和细胞死亡。
4)考虑在染色缓冲液中加入HEPES,增加CO2的缓冲。
5)了解细胞的大小以及它们是否表达任何荧光蛋白或是否具有任何荧光特性。
<hr/>03.样品染色
设计流式细胞术的方案和检测流程时,由于有许多变量需要优化而需要进行一些问题排查。在开始新的流式细胞术实验时,最好在各种条件下进行预实验,以便优化实验流程。在研究不同细胞或分析不同抗原时,实验方案和染色条件也许不能直接套用。抗体孵育的时间和温度可能影响受体染色,此步骤需要进一步优化(图3)。
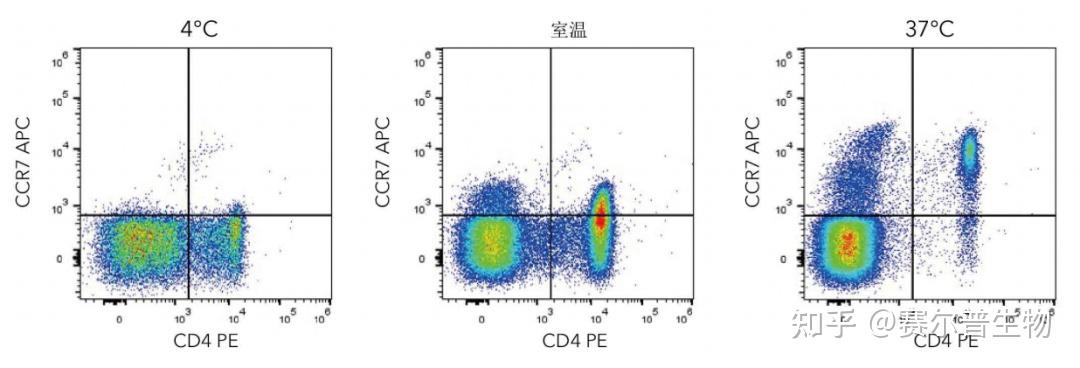
图3.温度对染色的影响。只有在最佳染色条件下,CCR7表位才能染上。在4°C下细胞产生了低的CCR7信号。在相同的细胞制备条件下,随着抗体孵育温度升高至室温和37°C,CCR7的检测(R&DSystems货号FAB197A)得到改善。尽管CCR7染色在37°C时最为理想,但其他受体的检测也许在4°C时最佳。
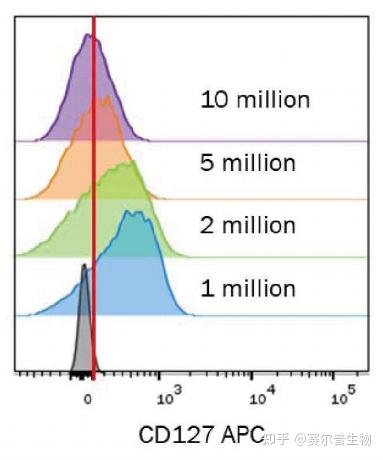
图4.细胞密度对染色的影响。不同细胞量的CD127+T细胞经过固定浓度的CD127APC抗体(R&DSystems 货号FAB306A)染色。100万个细胞染色效果最佳,超过200万个细胞的染色会导致信号减弱。这种损失是因为抗体稀释过度,无法与所有的抗原表位结合而导致的。
体生产商通常利用固定数量的细胞来进行抗体稀释,如每个样品有100万个细胞。这对于低密度标志物如CD127而言尤其重要,因为细胞数量对染色有相当大的影响(图4)。
<hr/>优化样品染色条件的更多建议:
1.每次都加入鉴定细胞活力的染料。
2.滴定每批试剂,以实现最佳的信噪比(一抗、二抗、活力染料等)。在右侧的例子中,1:10的稀释显示了最佳的信噪比。
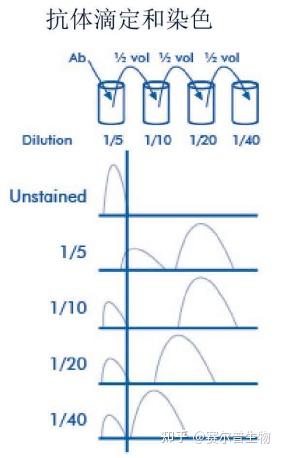
3.细胞内染色还有一些特殊的考虑因素。
(1)在染色细胞内蛋白时,细胞悬液需要固定和透化,然后再加入抗体。这种固定和透化处理让抗体穿过细胞膜进入细胞内部,同时维持细胞分选所需用到的形态特征

(2)在对细胞因子等分泌蛋白进行染色时,需要蛋白质转运抑制剂(莫能菌素或布雷菲德菌素A),将细胞因子保留在细胞内。这些化合物通过破坏内质网-高尔基体转运机制,阻止新合成蛋白质的输出。对于刺激时间超过4-6小时的实验处理,分泌抑制剂可存在于整个孵育期内。若刺激时间低于4-6小时,则分泌抑制剂应在孵育的最后两小时加入;
(3)不要将复合染料用在胞内蛋白染色上-这些偶联物分子量大,较难穿透细胞膜以及从细胞中洗掉。
往期高赞内容推荐:
合集 | SCI论文最标准的Figure图处理规范(含详细工具)
科研绘图王炸:最全矢量素材免费网站/软件合集!
科研画图都用什么软件?
ImageJ定量分析 WB 灰度值(详解版)
赛尔普生物:9个Western Blot工具,帮你搞定实验最关键的一步!
如何查看国家自然科学基金的的摘要和下载结题报告?
赛尔普生物:查询历年国自然科学基金项目?这8个网站必看!
免费好用的PDF编辑器,推荐一下?
白嫖这12个插件,让你的Zotero成为地表最强文献管理器!
赛尔普生物:强推ScienceSlides!好用到离谱的科研插画神器!
endnote x9 激活版下载!
生信分析入门 | 看完别说你不会生信了
原文地址:https://zhuanlan.zhihu.com/p/639673782 |
|
 /3
/3 