金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
实验笔记丨ELISA实验,你真的学废了吗?
酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)指将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原抗体特异性结合进行免疫反应的定性和定量检测方法。利用这种基于抗原抗体杂交的技术,我们可以量化检测可溶性物质,如蛋白质,在ELISA中,抗原作为目标分子,被固定在(特定的固相载体上),并被特异性的,与酶偶联的抗体检测,当提供无色底物时,酶产生可测量的有色底物。
ELISA法是免疫诊断中的一项新技术,现已成功地应用于多种病原微生物所引起的传染病、寄生虫病及非传染病等方面的免疫诊断。也已应用于大分子抗原和小分子抗原的定量测定,根据已经使用的结果,认为ELISA法具有灵敏、特异、简单、快速、稳定及易于自动化操作等特点。不仅适用于临床标本的检查,而且由于一天之内可以检查几百甚至上千份标本,因此,也适合于血清流行病学调查。本法不仅可以用来测定抗体,而且也可用于测定体液中的循环抗原,所以也是一种早期诊断的良好方法。因此ELISA法在生物医学各领域的应用范围日益扩大。
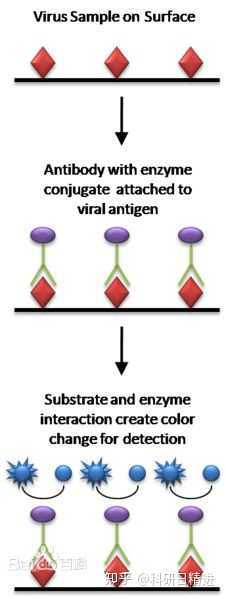
酶联免疫吸附试验(ELISA)是最常用的血清学检测方法,既可以检测抗原也可以检测抗体,主要包括间接ELISA、竞争ELISA、捕获 ELISA以及双抗夹心ELISA。其中,间接 ELISA操作相对简便,结果清晰,在抗体的检测中最为常用。该方法灵敏度高、特异性好,并且可以实现批量检测,适合用于对临床样品的大批量检测。
实验步骤
间接法 - 常用于检测抗体
(1)按实验需求配置标准品,S0-S7;
(2)稀释待测样本和加样;
(3)配置抗体,加样,室温孵育1-2h;
(4)配置洗涤液;
(5)洗板;
(6)配置辣根过氧化物酶标记亲和素工作液(HRP);
(7)3次洗涤结束后,加入稀释后的 HRP 100µL/孔,室温孵育1h;
(8)洗板;
(9)加底物溶液;
(10)加终止液;
(11)加入终止液,使用酶标仪测定各孔吸光值(OD 值)。
注意事项
温育是ELISA测定中最容易出现问题的步骤。温育温度应在37℃,水浴。温育时间应按照试剂说明书上的时间严格执行。温育实际测定操作中要注意以下几点:
1)要保证在设定的温度下有足够的反应时间。温育时间不够,弱阳性样本测不出来。
2)因为采用水浴,所以在温育时一定要封板,防止水蒸气形成水滴掉入反应孔内造成污染,并有可能整板花板。
全自动洗板机的使用应注意以下几点:
1)洗板前,应检查洗液瓶、蒸馏水瓶是否充足,废液瓶是否满瓶。
2)在自检过程中注意观察洗液灌注是否通畅,排液是否通畅。3)在洗板过程中,应注意观察反应孔每孔是否灌满且无外溢,每孔吸水是否吸尽,并且要保证洗液在孔中放置的时间。如果手工洗板的话就更需要操作者的操作技巧。
更多实验笔记干货,请关注“科研日精进”微信公众号 |
|
 /3
/3 