金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|

在生命科学领域有许多情况下,及时和经济地测定和量化样品中的抗原或抗体是很重要的。从确定接种疫苗或感染者的免疫反应,检测你希望在细胞表面表达的蛋白质表达,到进行质量控制测试,拥有一个能够进行此类评估的工具是其中关键。
ELISA检测(ELISA)就是这样一种测试,它已被证明是非常宝贵的研究和诊断工具。在这篇文章中,我们将考虑什么是ELISA,它是如何工作的,该技术的变化以及它能告诉你什么。
1、什么是ELISA测试?
ELISA检测是一种免疫检测方法,通常用于测量生物样品中的抗体或抗原,包括蛋白质或糖蛋白。像其他免疫检测法一样,它们依靠抗体与目标的结合来促进检测。
通常情况下,ELISA检测是在96孔板中进行的,这种形式使其适合于一次筛选许多样品。血清、血浆、细胞培养上清液、细胞裂解液、唾液、组织裂解液和尿液都是用于这些检测的常见样品类型,但理论上大多数液体样品类型都可以使用。然而,重要的是要考虑到一些样品类型可能包括抑制性因素,如共享相似抗原表位的缓冲液成分[1]或可能损害目标或检测成分的蛋白酶[2]等因素,这些因素可能干扰检测的性能。
有几种不同的检测形式,但都依赖于目标本身或能够捕获目标的抗体/抗原与包被板表面的结合。然后采用测定步骤,包括结合抗原,或更常见的抗体,以使成功的结合被测定和量化,最常见的是通过比色测定。
2、ELISA测试的类型和示意图
ELISA最初是由瑞典斯德哥尔摩大学的Eva Engvall和Peter Perlman[3]以及荷兰的Anton Schuurs和Bauke van Weemen[4]独立构思的。他们寻求一种能够测定抗原或抗体存在的免疫检测方法来取代放射免疫检测,因为放射免疫检测采用的是具有潜在危险的放射性标记抗原或抗体,因此他们设计了一种基于酶的替代品。
现在有四种主要的ELISA类型,直接法、间接法、夹心法和竞争法。下面的图片(图1)说明了抗原的测定;然而,同样的原理也适用于抗体的测定,只是抗原和一级抗体的作用相反。

图1 | ELISA的类型
2.1、ELISA直接法
在ELISA直接法中,样品中的抗原或抗体以非特异性方式直接吸附在包被板上。然后,将特异性测定抗体或抗原连接到孔中。之后,测定底物被用来产生可测量的颜色变化,并在读板器上进行量化。
由于这种检测方法步骤少,速度快,而且比其他ELISA方法更少有机会引入错误。然而,由于吸附步骤是非特异性的,背景噪音可能很高。没有二级抗体步骤意味着没有信号放大,降低了检测灵敏度。它还需要为每个所需目标创建共轭测定抗体/抗原。
2.2、ELISA间接法
ELISA间接法,或称iELISA,最初于1978年开发,用于检测人血清白蛋白,其工作方式与ELISA直接法非常相似,只是增加了一个二级抗体步骤。这使得测试信号得到放大,克服了ELISA直接法的局限性。
它还否定了对目标特异性共轭测定抗体/抗原的需要,因为共轭的二级抗体只需要对一级抗体具有物种特异性。如果总的样品抗原被结合到包被板上,就像ELISA直接法一样,背景噪音仍然是一个问题。
然而,如果该检测方法用于检测样品抗体,纯化的目标抗原被涂在板上,而一级抗体来自于样品。这大大减少了背景噪音,因此这些检测方法在确定样品中的抗体滴度时最受欢迎。
ELISA间接法的缺点包括方案时间较长,有更多出错机会,以及可能与二级抗体产生交叉反应。
2.3、ELISA夹心法
顾名思义,ELISA夹心法将抗原夹在抗体之间,该技术开发于1977年[6],可以采用ELISA直接或间接法的形式(上面描述的ELISA夹心法是基于ELISA间接法),除了抗原与检测板的非特异性结合,捕获抗体使其成为一个特异性的过程。这种组合进一步提高了检测的灵敏度和特异性。
然而,它们确实需要确定兼容的捕获和测定抗体对才能有效地发挥作用,而且可能有交叉反应的问题。这种检测方法通常也有最多的步骤,提供了更大的出错机会。由于抗原结合步骤的选择性,ELISA夹心法在抗原处于复杂混合状态时特别有用,因为不需要纯化抗原。
2.4、ELISA竞争法
ELISA竞争法,也被称为ELISA抑制法或ELISA阻断法,可能是ELISA技术中最复杂的一种。
最初是在1976年[7]为检测人类绒毛膜促性腺激素而开发的,该检测方法通过检测对预期输出信号水平的干扰,产生一个反比关系。应用的样品中目标物越多,测定的输出信号就越低。
其他ELISA方法也可以被改变为竞争法。这里有两个一般的原则:样品抗原或抗体与参照物竞争,分别与有限数量的标记抗体或抗原结合;又或者,样品抗原或抗体可以与标记参照物竞争,分别与有限数量的抗体或抗原结合。
ELISA竞争法与它所采用的形式一样,具有一些相同的优点和缺点。然而,当抗原较小,限制了两个抗体同时结合的能力(如ELISA夹心法所要求的),或者只有一个抗体可用时,它的作用就凸显了出来。
3、ELISA检测步骤
虽然不同类型的ELISA方案有差异,但大多数检测都有一些应该考虑共同的阶段。
3.1、板包被
大多数ELISA检测第一步是将检测的第一个成分与包被板结合。这通常是通过被动吸附完成的,一个非特异性的过程,所以结果将取决于涂在包被板上的东西。
如果使用了含有抗原的样品,那就需要一个具有选择性的包被板,因为各种抗原都会结合,而不仅仅是那些感兴趣的。然而,如果像用于抗体检测的ELISA间接法那样使用纯化抗原,或像ELISA夹心法那样使用捕获抗体,那么我们已经准备了一个具有选择性的包被板。
包被板的类型大多数是聚苯乙烯或聚苯乙烯衍生物,其具有不同的结合特性,这取决于目标物质和检测的性质。一些目标物质,包括重度糖基化的蛋白质、碳水化合物、DNA、脂类、短肽和有洗涤剂的蛋白质,是不能很好吸附的。在这些情况下,建议使用经过处理允许共价连接到表面的包被板。
3.2、孵育
将试剂加入ELISA板后,必须进行孵育,以便有时间进行结合或反应。每次孵育的温度和时间将取决于检测步骤和正在进行的操作。通常在样品应用之后,与37℃下孵育1小时。
然而,像阻断这样的步骤可以在冰箱中过夜,测定过程中的孵育通常在室温下进行,时间短得多。
3.3、洗涤
洗板是在应用在检测每个组成部分之间,直到结果测定的一个重要步骤。溶液从孔中排空后,通常使用磷酸盐缓冲盐水-20(PBST)做为缓冲液清洗孔,以去除任何残留的未结合抗原、抗体或试剂。
这可以用多通道移液器手工完成,或使用自动洗板机。
不充分的清洗可能会导致高背景信号,而过多的清洗会导致样品信号低。不一致的清洗可能会导致整个板块的不一致,从而导致不可靠的结果。
3.4、阻断
在用蛋白质包被ELISA板后,阻断通常是必要的,以防止在接下来方案步骤中测定抗体的任何非特异性结合(图2)。
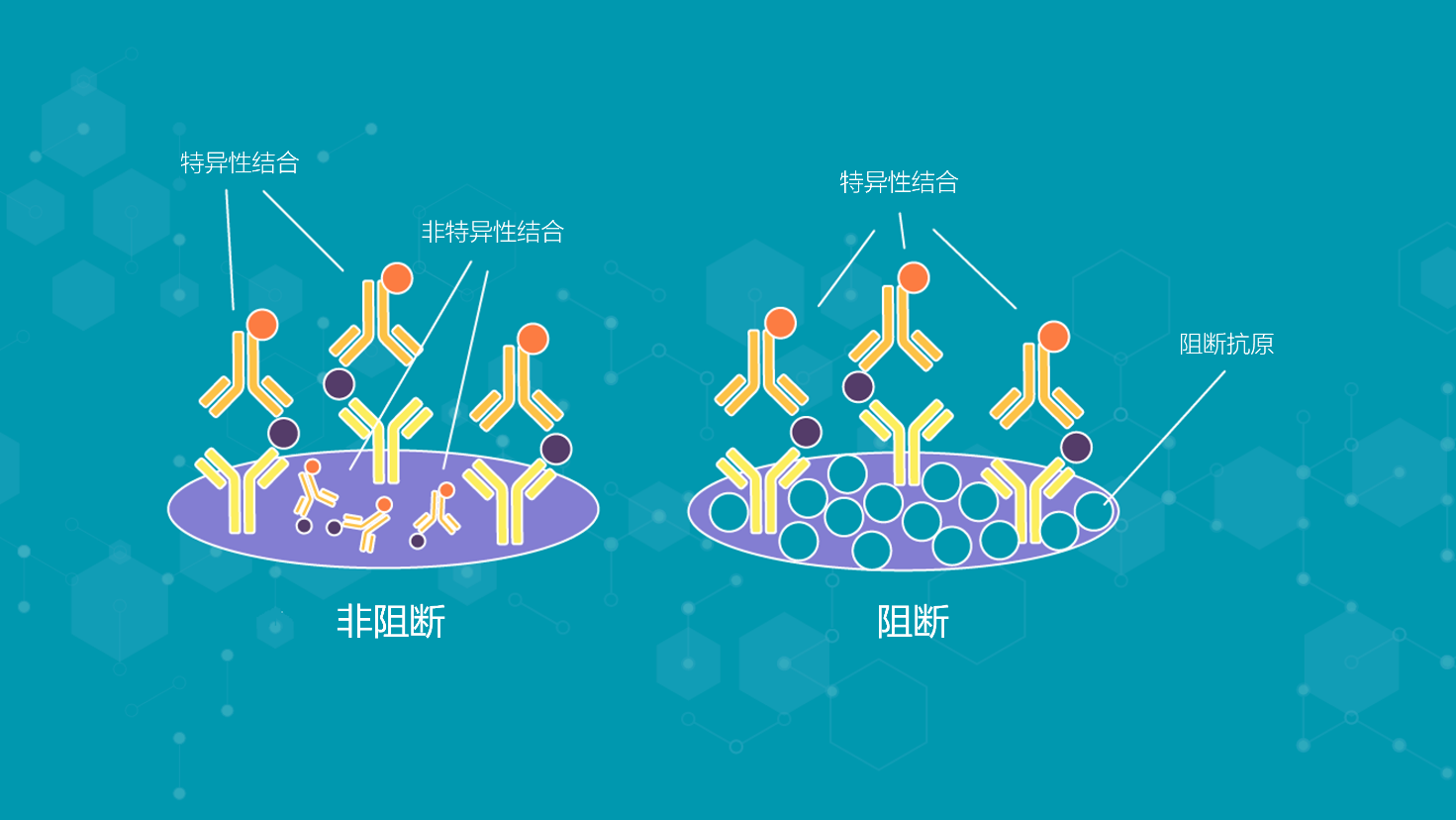
图2 | 阻断过程如何防止非特异性结合
与检测无关的混合蛋白被添加到板中并进行孵育,占据任何可用的非特异性结合位点。常见的蛋白质阻断缓冲液选择包括脱脂干乳、牛血清白蛋白(BSA)和酪蛋白。
另外,非离子洗涤剂,如Tween 20或Triton X-100,可作为阻断剂使用,但不能像蛋白质那样提供永久性阻断。无效的板块阻断会导致背景噪音增加,降低检测的灵敏度和特异性。
3.5、抗体
实验性抗体是大多数ELISAs的基石,选择正确的抗体至关重要,特别是在使用多种抗体的情况下。单克隆抗体和多克隆抗体都可以使用,它们都有各自的有点和缺点。单克隆抗体提供高特异性,但成本较高。另一方面,多克隆抗体可以在多个结合点与目标结合,放大信号并提高灵敏度。
使用采用二级抗体的方法增加了额外的步骤,延长了检测时间,增加了出错机会,需要更多优化来找到合适的兼容抗体对。然而,使用多克隆二级抗体所带来的灵敏度提高可能使其成为一种值得或必须的有效检测方法发展方向。
3.6、测定
无论使用哪种ELISA类型,最后一步都是测定步骤,最常见的是利用酶介导的可见颜色变化化学反应,然后可以用紫外-可见分光光度法测量。
酶结合抗原或抗体被应用到测试孔中,如果目标存在,它就会与之结合。当酶的适当底物被添加到包被板上时,它会引起颜色变化,与孔内结合的目标物的数量成正比。辣根过氧化物酶(HRP)是一种常用共轭物,一般与底物3,3',5,5'-四甲基联苯胺(TMB)合作使用。底物在HRP的作用下变成蓝色,然后在加入硫酸溶液后变成黄色,停止反应。
然后可以用酶标仪(在TMB加入终止液后,在450nm波段测定),这是一种紫外可见分光光度计,来确定每个孔的吸光度值,并根据检测设计进行校正和计算,如减去空白孔平均值、技术重复平均值或与标准比率计算。
图3描述了一个ELISA工作流程的例子。
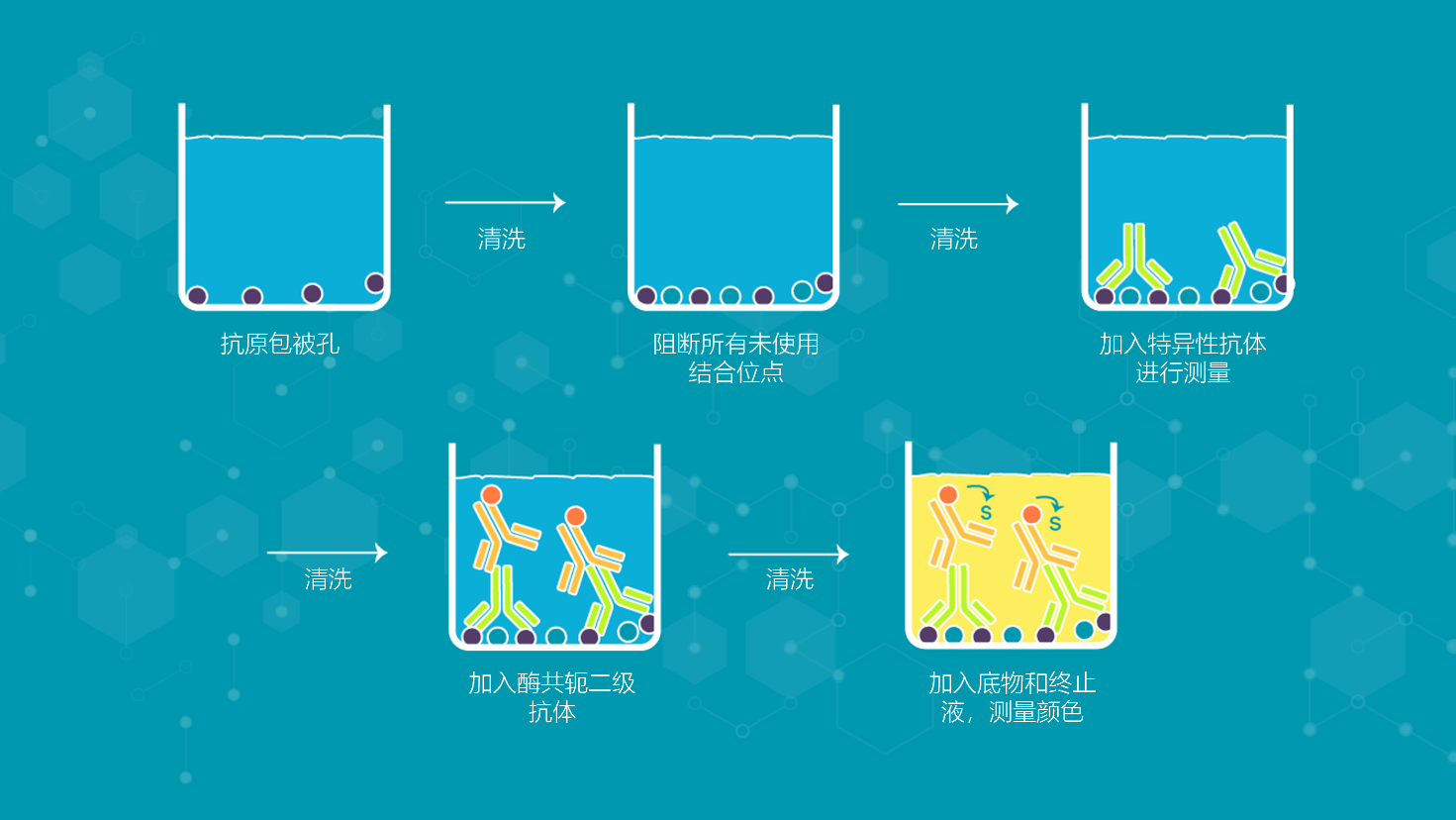
图3 | 一个iELISA工作流程的例子
4、解读ELISA测试结果
ELISA检测结果可以定量、定性或半定量地解释。在定量检测中,使用已知标准的连续稀释液来生成标准曲线,通常是光密度(OD)与浓度的关系。由此,可以计算出未知样品中目标物的精确数量(图4)。
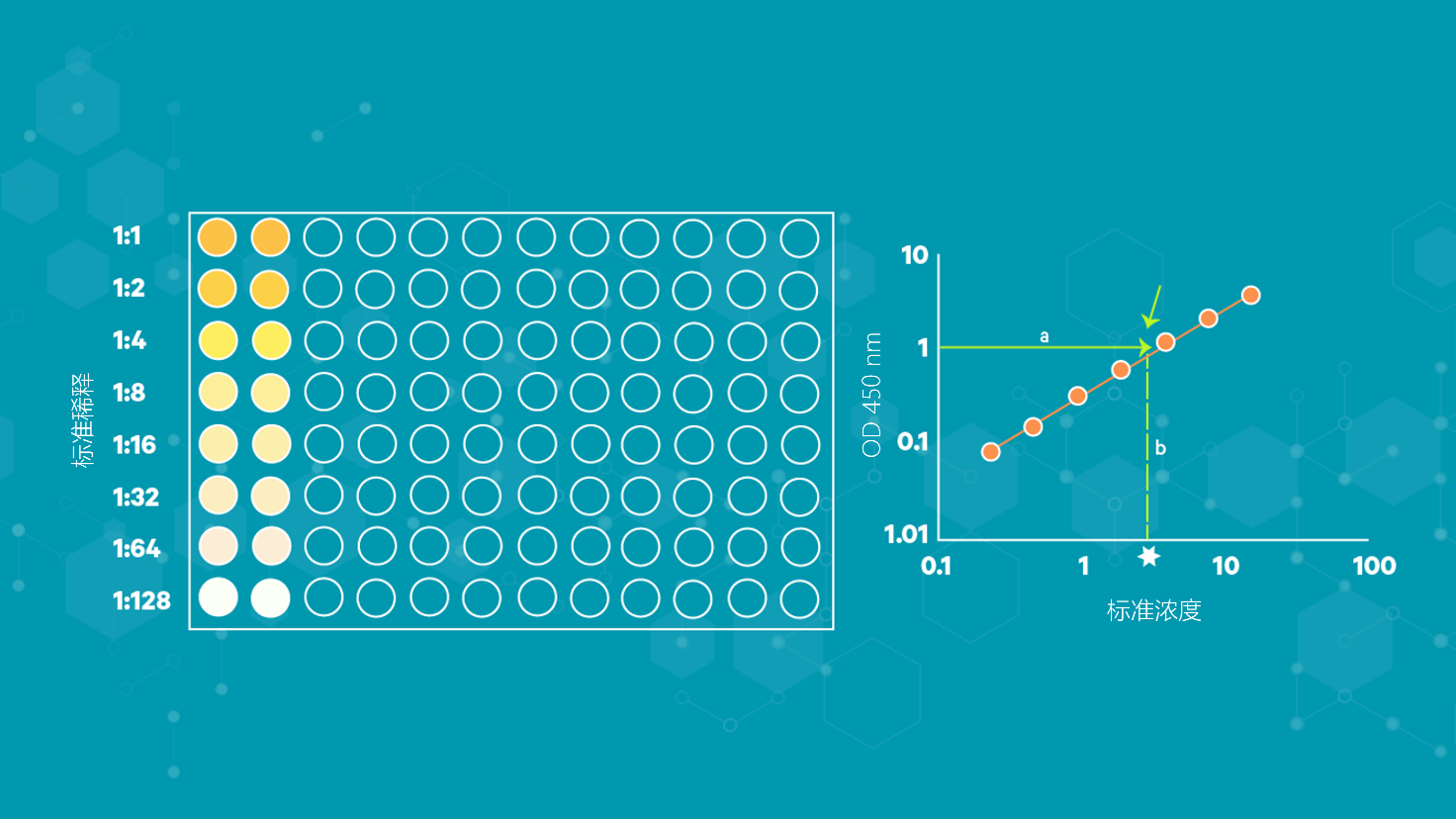
图4 | 标准曲线计算和ELISA实验中未知物目标浓度测定示例
在定性检测中,通常仍会通过使用酶标仪来收集数据,但结果将通过与没有标准曲线的空白和/或阴性孔的比较来解释为阳性或阴性。
半定量检测也是在不使用连续稀释或标准曲线的情况下收集数据。然而,包含阴性和阳性标准,通常是高阳性和低阳性,有利于相对比较未知样本井和已知状态的样本孔之间的水平。
通过使用这些标准来监测检测的可重复性,可以设定一个临界值,超过临界值的结果确定为阳性,低于临界值的为阴性。一些检测方法可能还包括一个“灰区”。对于数值落在这个区域的样品,建议重新测试或进一步调查。
虽然定量检测在某些情况下可能是可取的,但在每块板上包含一条完整的标准曲线会占用宝贵的孔位。因此,根据用户希望从检测结果中获得的信息,存在一种权衡。
像许多检测方法一样,从ELISA获得的结果很少可能是100%准确的,假阳性和假阴性结果都有可能。因此,大多数测试将与灵敏度和特异性相关;它们越接近100%,测试就越好。
有许多因素会影响这些值,例如:
- 非特异性结合或交叉反应的高背景;
- 抗体对其目标亲和力差;
- 非最佳检测条件;
- 样本条件和复杂性。
因此,计算灵敏度和特异性的数值是许多ELISA检测方法发展的一个重要步骤,特别是在诊断环境中,以确定获得的任何结果的信息量和可靠性。
5、ELISA检测的应用
自其诞生以来,这种灵活和廉价的测试已经发现了许多用途,并将继续这样做。下面重点介绍其中的一些应用。
5.1、传染性疾病诊断
ELISA检测在诊断测试中特别受欢迎,它可以应用于检测传染病原体本身和它们在宿主中引起的抗体反应,这取决于所选择的检测方法。因此,ELISAs在识别可能构成感染威胁或需要治疗的受感染者,以及在流行病学监测中识别以前被感染过的康复者方面都很有用。
一些慢性感染,特别是传染源负荷上升和下降的情况下,如果单纯依靠检测传染源,可能很难发现。然而,在这些人中可以检测到持续的抗体反应[8],即使微生物本身不能检测到,也有助于准确定位这些人。
第一个人类免疫缺陷病毒(HIV)的通用测试方法[9]是在1985年开发的,是一种测定人类血清胱抑素C的ELISA检测。许多其他疾病可以用ELISA诊断人类和动物,包括登革热[10]、乙型肝炎[11]、SARS-CoV-2[12, 13]、马氏链球菌[8]和大肠杆菌[14]。
lipoarabinomannan(LAM)ELISA检测是一种检测方法,用于测定结核病(TB)患者尿液中的LAM,一种免疫原性的霉菌细胞壁抗原。鉴于与结核病有关的全球流行率和死亡率以及替代性结核病诊断的挑战,它是一种急需的筛查工具。然而,它的灵敏度水平[15]和临床效用[16]一直受到批评。
但是,很多科学家都在努力解决这些问题[17]。已有人将该测试扩展到其他样本类型,包括痰[18]和血清,但可惜的是成效不大。
5.2、食物过敏原的检测
过敏原[19]如果被受影响的人摄入,可能是致命的,所以对于食品来说,宣布不含某些过敏原,如花生[20],是至关重要的。
ELISA为此提供了极好的灵敏度,在某些情况下可低至百万分之一(ppm),并且能够应对一些食品类型,如油和奶,而其他方法如PCR则难以应对。然而,一些食品的加工过程,如加热会改变过敏原构象,这会对ELISA测定产生负面影响[21]。
5.3、生物仿制药和生物制药检测
随着生物仿制药的发展,有必要证明它们与它们要模仿参考药物之间的相似性。在这里,ELISA也发挥了在确定药物总浓度和检测杂质等因素方面的效用[22]。
5.4、癌症生物标志物测试
癌症生物标志物[23]通常可以在血液样本中检测出来。因此,ELISA测试可以作为一种非侵入性的方法,用来测定和量化已知的生物标志物。
5.5、法医药物检测
ELISA检测可被毒理学家用于筛选法医样品中的滥用药物痕迹[24],包括安非他命、可卡因、鸦片制剂、美沙酮、苯并二氮杂卓和大麻素。虽然液体样品,如尿液或血液比较容易处理,但也可以对固体样品,如头发,进行ELISA分析。
5.6、怀孕测试
人绒毛膜促性腺激素(hCG)是怀孕时产生的一种激素[25],可以通过ELISA在尿液样品中检测。
5.7、自身免疫性疾病
指示自身免疫性疾病的标志物,如类风湿性关节炎[26]和红斑狼疮[27],可通过ELISA测定和定量。
诊断科学编辑团队收集、整理和编撰,如需更多资讯,请关注公众号诊断科学(DiagnosticsScience)。
参考文献
- Waritani T, Chang J, McKinney B, Terato K. An ELISA protocol to improve the accuracy and reliability of serological antibody assays. MethodsX. 2017;4:153-165. doi:10.1016/j.mex.2017.03.002
- López-Otín C, Bond JS. Proteases: Multifunctional enzymes in life and disease. J Biol Chem. 2008;283(45):30433-30437. doi:10.1074/jbc.R800035200
- Engvall E, Perlmann P. Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G. Immunochemistry. 1971;8(9):871-874. doi:10.1016/0019-2791(71)90454-X
- Weemen BKV, Schuurs AHWM. Immunoassay using antigen—enzyme conjugates. FEBS Letters. 1971;15(3):232-236. doi:10.1016/0014-5793(71)80319-8
- Lindström P, Wager O. IgG autoantibody to human serum albumin studied by the ELISA-technique. Scand J Immunol. 1978;7(5):419-425. doi:10.1111/j.1365-3083.1978.tb00472.x
- Kato K, Hamaguchi Y, Okawa S, et al. Use of rabbit antibody IgG bound onto plain and aminoalkylsilyl glass surface for the enzyme-linked sandwich immunoassay. J Biochem. 1977;82(1):261-266. doi:10.1093/oxfordjournals.jbchem.a131678
- Yorde DE, Sasse EA, Wang TY, Hussa RO, Garancis JC. Competitive enzyme-linked immunoassay with use of soluble enzyme/antibody immune complexes for labeling. I. Measurement of human choriogonadotropin. Clin Chem. 1976;22(8):1372-1377. doi: 10.1093/clinchem/22.8.1372
- Robinson C, Steward KF, Potts N, et al. Combining two serological assays optimises sensitivity and specificity for the identification of Streptococcus equi subsp. equi exposure. Vet. J. 2013;197(2):188-191. doi:10.1016/j.tvjl.2013.01.033
- Alexander TS. Human immunodeficiency virus diagnostic testing: 30 years of evolution. Clin Vaccine Immunol. 2016;23(4):249-253. doi:10.1128/CVI.00053-16
- Narayan R, Raja S, Kumar S, et al. A novel indirect ELISA for diagnosis of dengue fever. Indian J Med Res. 2016;144(1):128-133. doi:10.4103/0971-5916.193300
- Kim S-H. ELISA for Quantitative determination of hepatitis B virus surface antigen. Immune Netw. 2017;17(6):451-459. doi:10.4110/in.2017.17.6.451
- MacMullan MA, Ibrayeva A, Trettner K, et al. ELISA detection of SARS-CoV-2 antibodies in saliva. Sci Rep. 2020;10(1):20818. doi:10.1038/s41598-020-77555-4
- Freeman B, Lester S, Mills L, et al. Validation of a SARS-CoV-2 spike protein ELISA for use in contact investigations and serosurveillance. bioRxiv. Published online April 25, 2020:2020.04.24.057323. doi:10.1101/2020.04.24.057323
- Tong C, Wu Z, Yu L, et al. Development of an indirect ELISA for detection of E. coli antibodies in cow serum using a recombinant OmpT as antigen. J Immunoassay Immunochem. 2014;35(3):241-255. doi:10.1080/15321819.2013.848812
- Reither K, Saathoff E, Jung J, et al. Low sensitivity of a urine LAM-ELISA in the diagnosis of pulmonary tuberculosis. BMC Infect Dis. 2009;9(1):141. doi:10.1186/1471-2334-9-141
- Dheda K, Davids V, Lenders L, et al. Clinical utility of a commercial LAM-ELISA assay for TB diagnosis in HIV-infected patients using urine and sputum samples. PLoS One. 2010;5(3):e9848. doi:10.1371/journal.pone.0009848
- Amin AG, De P, Graham B, Calderon RI, Franke MF, Chatterjee D. Urine lipoarabinomannan in HIV uninfected, smear negative, symptomatic TB patients: effective sample pretreatment for a sensitive immunoassay and mass spectrometry. Sci Rep. 2021;11(1):2922. doi:10.1038/s41598-021-82445-4
- Peter JG, Cashmore TJ, Meldau R, Theron G, van Zyl-Smit R, Dheda K. Diagnostic accuracy of induced sputum LAM ELISA for tuberculosis diagnosis in sputum-scarce patients. Int J Tuberc Lung Dis. 2012;16(8):1108-1112. doi:10.5588/ijtld.11.0614
- Iqbal A, Farooq S, Jamal Y, et al. Detection of food allergens by ELISA and other common methods. Fresenius Environ. Bull. 2018;27(12): 8340-8346.
- Pandey AK, Varshney RK, Sudini HK, Pandey MK. An improved enzyme-linked immunosorbent assay (ELISA) based protocol using seeds for detection of five major peanut allergens Ara h 1, Ara h 2, Ara h 3, Ara h 6, and Ara h 8. Front Nutr. 2019;6:68. doi:10.3389/fnut.2019.00068
- Taylor SL, Nordlee JA, Niemann LM, Lambrecht DM. Allergen immunoassays--considerations for use of naturally incurred standards. Anal Bioanal Chem. 2009;395(1):83-92. doi:10.1007/s00216-009-2944-0
- Li M, An W, Wang L, et al. Production of monoclonal antibodies for measuring Avastin and its biosimilar by Sandwich ELISA. J Immunol Methods. 2019;469:42-46. doi:10.1016/j.jim.2019.03.013
- Dou Y, Lv Y, Zhou X, et al. Antibody-sandwich ELISA analysis of a novel blood biomarker of CST4 in gastrointestinal cancers. Onco Targets Ther. 2018;11:1743-1756. doi:10.2147/OTT.S149204
- Agius R, Nadulski T. Utility of ELISA screening for the monitoring of abstinence from illegal and legal drugs in hair and urine. Drug Test Anal. 2014;6(S1):101-109. doi:10.1002/dta.1644
- Podrouzek P, Krabec Z, Mancal P, Presl J. The development and evaluation of Sevatest ELISA hCG Micro I. kit as a test for pregnancy. J Hyg Epidemiol Microbiol Immunol. 1988;32(4):467-476. PMID: 3221094
- Suzuki K, Sawada T, Murakami A, et al. High diagnostic performance of ELISA detection of antibodies to citrullinated antigens in rheumatoid arthritis. Scand J Rheumatol. 2003;32(4):197-204. doi:10.1080/03009740310003677
- Dillon SP, D’Souza A, Kurien BT, Scofield RH. Systemic lupus erythematosus and C1q: A quantitative ELISA for determining C1q levels in serum. Biotechnol J. 2009;4(8):1210-1214. doi:10.1002/biot.200800273
*** |
|
 /3
/3 