金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
我们在实验过程中,根据实验目的,对所获得的样本进行病理检测,样本固定是最重要的一环,固定方法选择不当会增加后续实验难度,甚至造成后续实验失败,因此根据样本种类和实验目的选择的方法尤为重要。那么今天就浅浅聊一下这方面的知识,希望对大家的实验有所帮助。
一、组织样本固定及运输条件
1.常规病理检测动物组织样本,用10%中性福尔马林固定液固定。
2.冰冻切片组织样本,用OCT包埋,液氮速冻,-80℃液氮保存。
3.免疫组化和荧光组织样本,用4%多聚甲醛固定液固定。
4.电镜组织样本,用2.5%戊二醛固定,4℃保存。
5.常规病理检测植物组织样本,用FAA(福尔马林-醋酸-酒精)固定液固定。
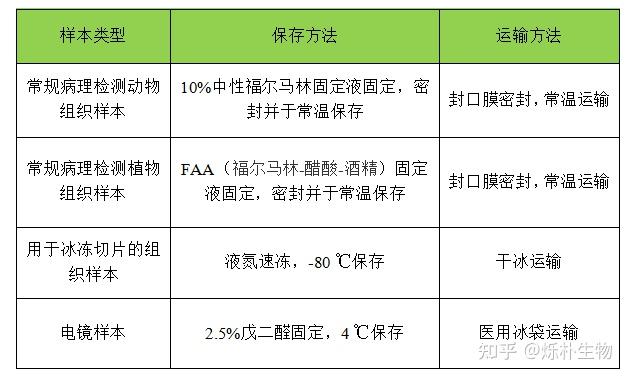
6.特殊的组织样本需用特殊固定液,比如眼球用Davidson固定液。
二、组织样本固定过程中注意事项
1.动物解剖后固定有两个基本原则:①组织离体后在30min内完成保存或固定;②固定液充足,固定液体积:组织体积=10:1。
2.将组织块投入固定液之后可以用摇床帮助固定,使组织块充分接触固定液,勿使其粘附于瓶底或瓶壁。
3.固定用容器应根据样本体积而定,不宜用V型底,细长管状容器保存。
4.组织如覆有血液或污物等,固定前用生理盐水洗去,以达到最佳的固定效果。
5.小动物脑垂体、主动脉、坐骨神经和眼球及其附属腺等易丢失的脏器放在包埋盒或Eppendorf管等另行固定。
6.大组织样本应切开固定,以免内部区域因固定不及时自溶腐败。
7.胃、肠道的内容物处理时不能挤压 ,防止破坏黏膜 ,可用注射器注射10%中性福尔马林或者4%多聚甲醛进入组织进行预固定,等待30min左右后,使用PBS清洗内容物。
8.肺等有较大空腔的组织,选择在固定液上放湿棉花团 ,防止组织漂浮在固定液上导致固定不充分。
三、细胞样本固定及运输条件
1.细胞爬片:爬片放入12或24孔板内,PBS清洗后4%多聚甲醛固定,-20℃保存,常温运输。
2.贴壁细胞:消化后,离心,保留细胞沉淀,PBS清洗,离心,保留细胞沉淀 ,4%多聚甲醛重悬,常温运输。
3.悬浮细胞:离心,保留细胞沉淀,PBS清洗,离心,保留细胞沉淀 ,4%多聚甲醛重悬,常温运输。
样本种类和实验目的多种多样,根据实验目的选择适合的方法实验就成功了一半。小伙伴们还有其他想了解的内容,可以后台私信我们呦~ |
|
 /3
/3 