金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
2020年诺贝尔化学奖揭晓
北京时间10月7日晚,2020年诺贝尔化学奖颁给了2020年诺贝尔化学奖已授予Emmanuelle Charpentier和Jennifer A. Doudna.
表彰其在「用于开发基因组编辑方法」的工作(就是CRISPR啦)
获奖人简介
Emmanuelle Charpentier

Emmanuelle Charpentier博士,法籍微生物学家,现为德国马克斯·普朗克研究所感染生物学研究所所长。在CRISPR的发展中,其主要的贡献在于发现Cas9蛋白的活性仰赖tracrRNA。
Jennifer A. Doudna

Jennifer A. Doudna博士,为伯克利大学化学和分子生物学与细胞生物学教授,霍华德休斯医学研究所的研究员,美国国家科学院院士。她与Emmanuelle Charpentier博士共同发现Cas9 的切割作用和,crRNA 的定位作用,并将crRNA与tracrRNA可以融合成单链引导RNA(sgRNA)。
。。。
CRISPR已经是目前生物医学方面非常普及的的基因编辑技术,近几年该技术的飞速发展,推广应用到了生物、医学、农业以及环境等多个领域,造就了一批批科研奇迹,尤其是在遗传病的治疗、疾病相关基因的筛查与检测、肿瘤治疗以及动植物的改造、病原微生物防治等领域有着巨大的潜力,也将深远地影响整个世界。
1. 什么是CRISPR
CRISPR的全称是Clustered Regularly Interspaced Short Palindromic Repeats,中文翻译为“规律成簇的间隔短回文重复”。这个词的字面意思就是“代表了同一类特征明显、排列整齐、秩序一致的重复序列”。它作为细菌的适应性免疫系统,当外源病毒或质粒DNA进入细胞时,专门的Cas蛋白会将外源DNA剪成小片段,并将它们粘贴到自身的DNA片段中存储。当再次遇到病毒入侵时,细菌能够根据存储的片段识别病毒,将病毒的DNA切断而使之失效(1)。
科学家利用CRISPR的这一功能,将其改造成为一种革命性的新型分子工具。由于它具有精准的定位和切割任何种类的遗传物质的能力,使得科学家能够更得心应手地破解地球上任何生物(包括人类)的生命密码。
2. CRISPR 简史
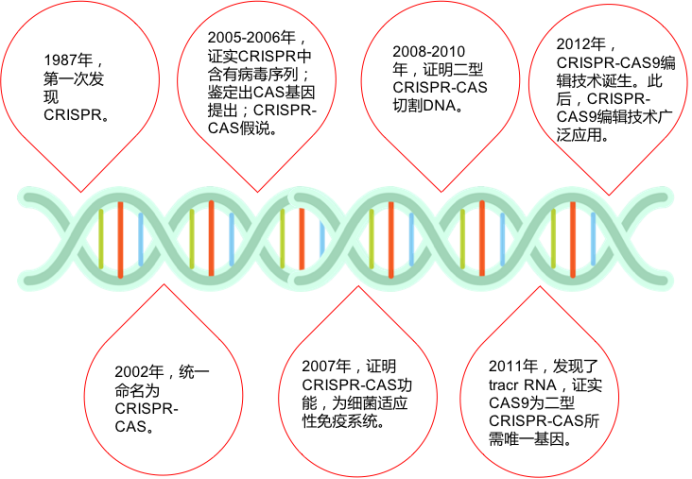
图1:CRISPR发展简史
CRISPR的发现与命名
早在1987年,日本大阪大学的Nakata研究组在分析大肠杆菌时就发现,细菌中存在一些异常重复的序列(2)。但当时人们并不知道这些重复序列究竟有什么作用,甚至还没有正式为这些重复序列命名。直到20世纪80年代末,西班牙阿利坎特大学的Francisco Mojica再次在一种古菌种发现了类似的重复序列(3),这引起了他极大的兴趣。在随后的研究中,他一直在微生物中寻找类似结构,到2000年他已经在20多种不同的微生物种中发现了这一类似的序列(4)。2002年,荷兰乌得勒支大学的Ruud Jansen发现不同物种的重复序列碱基数存在巨大差异,并且这种序列仅存在于原核生物中。为了更好地规范相关的研究,他们共同为这种重复序列命名为“CRISPR”。。多个CRISPR相关基因则被命名为Cas(CRISPR-associated)家族(5)。
CRISPR-CAS系统的生物学作用
2005年,CRISPR研究迎来了一个重要发现,两个研究小组(Mojica和Pourcel)都观察到了CRISPR重复序列之间的间隔序列并非来自于原核生物自身,而是来源于质粒或病毒(6,7)。因此,Mojica提出CRISPR是一种适应性免疫系统的假设。同年,Bolotin研究组在嗜热链球菌中发现了Cas9,并预测这个庞大的蛋白质具有核酸酶活性。他们还发现与病毒同源的间隔序列都具有一种类似的尾巴,称为PAM(protospacer adjacent motif)序列,它们对靶序列的识别至关重要。
受到这一假说的激发,当时还在著名的酸奶公司Danisco工作的法国微生物学家Rodolphe Barragou决定对其进行验证,以解决嗜热链球菌爆发噬菌体感染死亡而影响酸奶生产的问题。2007年,他们通过实验证明CRISPR系统确实是一种适应性免疫系统。嗜热链球菌被病毒入侵后,整合了来自噬菌体基因组新的间隔序列,同样的病毒再次入侵时细菌就有了抵抗攻击能力(8)而Cas9蛋白可能是产生这种免疫能力所必需的。这是首次在实验上证实了CRISPR-Cas是一种细菌获得性免疫系统。
CRISPR-CAS的作用机制证实
CRISPR-CAS生物学功能的证实,使得许多研究团队认识到这一系统的重要性,随后许多研究团队纷纷开始补充CRISPR-Cas系统干扰噬菌体机制的细节。2008年,John van der Oost研究小组在大肠杆菌中发现,来自噬菌体的间隔序列被转录成小RNA,成为CRISPR RNA(crRNA),并引导Cas蛋白到靶DNA上。Marraffini和Sontheimer在同年证明了CRISPR-Cas系统的目标分子是DNA,而不是RNA。他们还明确指出,如果将该系统转移到非细菌系统中,可能成为一种强大的工具系统(9,10)。这为随后的基因编辑埋下了伏笔。
2010年12月,Moineau团队证明了CRISRP-Cas9在PAM序列上游位置的精确切割使DNA双链断裂。而作为II型CRISPR系统的显著特征,Cas9是切割唯一需要的蛋白,它与crRNAs共同介导CRISPR-Cas9的干扰功能(11)。
2011年,Charpentier研究组对酿脓链球菌进行了小RNA测序,发现除了crRNA以外,还存在一种小RNA,称为式激活CRISPR RNA(tracrRNA)。tracrRNA通过24个核苷酸与crRNA中的重复序列互补配对与形成双链,引导Cas9到靶DNA。至此,天然CRISPR-Cas9干扰机制的拼图基本拼搭完整(12)。
CRISPR-CAS基因编辑技术的出现
2012年Charpentier和Doudna团队合作,不仅证明Cas9具有切割DNA双链的能力,还能够将tracrRNA和crRNA链接成sgRNA(single guide RNA),并在体外实验中证实了sgRNA也可以指导Cas9蛋白完成对DNA的双链剪切。他们可以通过改变crRNA的序列控制Cas9的靶向位点(13)。随后Siksnys团队也报告了相同的发现。这一发现不仅是细菌获得性免疫系统领域的里程碑,更开启了CRISPR-CAS基因编辑技术的新篇章。很快,2013年初的多篇论文都将CRISPR-Cas系统成功地应用到了哺乳动物细胞中。其中,Church研究组设计了II型CRISPR-Cas系统,在人293T细胞、K562细胞以及诱导多能干细胞中通过设计sgRNA成功靶向特定序列,且多个gRNA可以实现对目标基因的多重编辑(15)。张锋实验室证明了CRISPR-Cas9系统可以在人类和小鼠细胞中进行精确的定点切割,并且将Cas9突变为缺口酶,促进同源修复过程(14)。Qi研究组则建立了CRISPRi系统,还实现了多sgRNAs 靶向多基因(Tet1、Tet2、Tet3、Sry 和Uty)的同时定点突变(16)。Wu等人利用CRISPR-Cas9系统对Crygc 显性突变的小鼠进行基因治疗使其获得了健康的后代,为CRISPR-Cas9 系统用于遗传疾病的基因治疗提供了依据(17)。
由此,CRISPR系统在多种生物的基因定点编辑、基因组筛选、基因转录调控、基因组成像、基因诊疗、生态应用等领域的研究与应用开始井喷。随后几年,张锋实验室更将CRISPR-CAS的基因编辑系统进行了拓展,不仅发现了在特异性和多基因编辑方面都有着很大优势的CRISPR-Cas系统:CRISPR-Cpf1(18),还发现具有RNA酶功能的CRISPR酶Cas13a(C2c2)(19)和Cas13b(20)。2017年,有多篇文章研究了CRISPR-Cas13系统的作用机制、在临床诊断中的应用以及在哺乳动物细胞靶向RNA的能力。
3. CRISPR 基因编辑技术的应用
CRISPR技术迅速发展使得它在转化医学和疾病治疗领域中的应用不断创造出惊喜。2015年Science杂志发表了成功使用CRISPR治疗遗传性疾病动物模型的方法。他们利用CRISPR系统编辑Dystrophin基因,能够不同程度修复杜氏肌营养不良症小鼠的肌肉功能,从而达到治疗DMD的效果(21)。2018年有研究证实利用CRISPR技术成功治疗了四只患有DMD(Duchenne型肌营养不良症)的狗,并将其肌肉和心脏组织中的营养不良蛋白恢复到正常水平的92%(22)。此外,CRISPR技术还与细胞免疫疗法相结合以完善CAR-T疗法,并在小鼠中增强了肿瘤抑制作用。首次利用CRISPR-Cas9在T细胞中敲除PD-1基因的临床试验已被批准用于治疗肌肉浸润性膀胱癌、去势抵抗性前列腺癌、转移性肾癌和转移性非小细胞肺癌,并在2016年开始了I期临床试验(23)。
4. CRISPR的其他应用
目前,CRISPR 并不止在基因组编辑得到了应用,在基因检测方面也展现了巨大的潜力。在2017年《Science》发表的研究中,Doudna 团队发现了一个很有趣的现象:CRISPR 系统在剪切靶向的双链 DNA 的同时,Cas12 的 DNA 酶活性会被激活(24)。这个发现为检测细胞内是否含有某目的DNA 提供了一个全新的思路:同时向细胞内递送靶向该 DNA 的 CRISPR-Cas12a 系统和非特异性 ssDNA 荧光报告基因(FQ-labeled reporter),一旦检测到目的 DNA,CRISPR-Cas12a 系统将启动,与此同时,荧光报告基因也会被降解,从而释放出荧光信号。利用这一技术,Doudna 团队开发了DETECTR系统,能够在一小时内100%准确检测出 HPV 16 感染,且单次测试成本不到一美元。与此同时,张锋团队也利用CRISPR-Cas13a开发出了SHERLOCK系统和SHERLOCKv2系统(25),与Doudna团队不同,张锋团队设计的荧光报告基因必须是特异性,也正是“特异性”这个优点使得 SHERLOCKv2 可以同时检测多种序列。张锋团队还开发了类似验孕棒的试纸检测方法,只需一张试纸,SHERLOCKv2 就能显示出病毒感染的检测结果,这使得检测更为便利。在今年COVID-19的检测技术开发中,SHERLOCKv2也曾一显身手。
虽然目前 DETECTR 和 SHERLOCK 已向我们展现出它们在诊断中的强大力量,但是在进入临床使用前,为了确保诊断的准确性,研究者们仍然需要做大量的工作。我们相信这些新的诊断工具必将改写未来的诊断技术,尤其是为那些卫生条件相对较差、病毒高发的发展中国家在病毒感染诊断上带来巨大的帮助。
参考文献:
1. Doudna JA, Charpentier E. Genome editing. The new frontier of genome engineering with CRISPR-Cas9. Science. 2014 Nov 28;346(6213):1258096. doi: 10.1126/science.1258096. PMID: 25430774..
2. Ishino Y, Shinagawa H, Makino K, Amemura M, Nakata A. Nucleotide sequence of the iap gene, responsible for alkaline phosphatase isozyme conversion in Escherichia coli, and identification of the gene product. J Bacteriol. 1987 Dec;169(12):5429-33. doi: 10.1128/jb.169.12.5429-5433.1987. PMID: 3316184; PMCID: PMC213968.
3. Lander ES. The Heroes of CRISPR. Cell. 2016 Jan 14;164(1-2):18-28. doi: 10.1016/j.cell.2015.12.041. PMID: 26771483.
4. Mojica FJ, Díez-Villaseñor C, Soria E, Juez G. Biological significance of a family of regularly spaced repeats in the genomes of Archaea, Bacteria and mitochondria. Mol Microbiol. 2000 Apr;36(1):244-6. doi: 10.1046/j.1365-2958.2000.01838.x. PMID: 10760181.
5. Jansen R, Embden JD, Gaastra W, Schouls LM. Identification of genes that are associated with DNA repeats in prokaryotes. Mol Microbiol. 2002 Mar;43(6):1565-75. doi: 10.1046/j.1365-2958.2002.02839.x. PMID: 11952905.
6. Mojica FJ, Díez-Villaseñor C, García-Martínez J, Soria E. Intervening sequences of regularly spaced prokaryotic repeats derive from foreign genetic elements. J Mol Evol. 2005 Feb;60(2):174-82. doi: 10.1007/s00239-004-0046-3. PMID: 15791728.
7. Pourcel C, Salvignol G, Vergnaud G. CRISPR elements in Yersinia pestis acquire new repeats by preferential uptake of bacteriophage DNA, and provide additional tools for evolutionary studies. Microbiology. 2005 Mar;151(Pt 3):653-663. doi: 10.1099/mic.0.27437-0. PMID: 15758212.
POURCEL C,SALVIGNOL G,VERGNAUD G.CRISPR elements in Yersinia pestis acquire new repeats by preferential uptake of bacteriophage DNA,and provide additional tools for evolutionary studies[J】.Microbiology,2005,15l(3):653—663.
8. Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P. CRISPR provides acquired resistance against viruses in prokaryotes. Science. 2007 Mar 23;315(5819):1709-12. doi: 10.1126/science.1138140. PMID: 17379808.
9. Marraffini LA, Sontheimer EJ. CRISPR interference limits horizontal gene transfer in staphylococci by targeting DNA. Science. 2008 Dec 19;322(5909):1843-5. doi: 10.1126/science.1165771. PMID: 19095942; PMCID: PMC2695655.
10. Abbott A. The quiet revolutionary: How the co-discovery of CRISPR explosively changed Emmanuelle Charpentier's life. Nature. 2016 Apr 28;532(7600):432-4. doi: 10.1038/532432a. PMID: 27121823.
11. Garneau JE, Dupuis MÈ, Villion M, Romero DA, Barrangou R, Boyaval P, Fremaux C, Horvath P, Magadán AH, Moineau S. The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA. Nature. 2010 Nov 4;468(7320):67-71. doi: 10.1038/nature09523. PMID: 21048762.
12. Deltcheva E, Chylinski K, Sharma CM, Gonzales K, Chao Y, Pirzada ZA, Eckert MR, Vogel J, Charpentier E. CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III. Nature. 2011 Mar 31;471(7340):602-7. doi: 10.1038/nature09886. PMID: 21455174; PMCID: PMC3070239.
13. Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17;337(6096):816-21. doi: 10.1126/science.1225829. Epub 2012 Jun 28. PMID: 22745249; PMCID: PMC6286148.
14. Cong L, Ran FA, Cox D, Lin S, Barretto R, Habib N, Hsu PD, Wu X, Jiang W, Marraffini LA, Zhang F. Multiplex genome engineering using CRISPR/Cas systems. Science. 2013 Feb 15;339(6121):819-23. doi: 10.1126/science.1231143. Epub 2013 Jan 3. PMID: 23287718; PMCID: PMC3795411.
15. Mali P, Yang L, Esvelt KM, Aach J, Guell M, DiCarlo JE, Norville JE, Church GM. RNA-guided human genome engineering via Cas9. Science. 2013 Feb 15;339(6121):823-6. doi: 10.1126/science.1232033. Epub 2013 Jan 3. PMID: 23287722; PMCID: PMC3712628.
16. Pennisi E. The CRISPR craze. Science. 2013 Aug 23;341(6148):833-6. doi: 10.1126/science.341.6148.833. PMID: 23970676.
17. Wu Y, Liang D, Wang Y, Bai M, Tang W, Bao S, Yan Z, Li D, Li J. Correction of a genetic disease in mouse via use of CRISPR-Cas9. Cell Stem Cell. 2013 Dec 5;13(6):659-62. doi: 10.1016/j.stem.2013.10.016. PMID: 24315440.
18. Zetsche B, Gootenberg JS, Abudayyeh OO, Slaymaker IM, Makarova KS, Essletzbichler P, Volz SE, Joung J, van der Oost J, Regev A, Koonin EV, Zhang F. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 2015 Oct 22;163(3):759-71. doi: 10.1016/j.cell.2015.09.038. Epub 2015 Sep 25. PMID: 26422227; PMCID: PMC4638220.
19. Gootenberg JS, Abudayyeh OO, Kellner MJ, Joung J, Collins JJ, Zhang F. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6. Science. 2018 Apr 27;360(6387):439-444. doi: 10.1126/science.aaq0179. Epub 2018 Feb 15. PMID: 29449508; PMCID: PMC5961727.
20. Cox DBT, Gootenberg JS, Abudayyeh OO, Franklin B, Kellner MJ, Joung J, Zhang F. RNA editing with CRISPR-Cas13. Science. 2017 Nov 24;358(6366):1019-1027. doi: 10.1126/science.aaq0180. Epub 2017 Oct 25. PMID: 29070703; PMCID: PMC5793859.
21. Long C, Amoasii L, Mireault AA, McAnally JR, Li H, Sanchez-Ortiz E, Bhattacharyya S, Shelton JM, Bassel-Duby R, Olson EN. Postnatal genome editing partially restores dystrophin expression in a mouse model of muscular dystrophy. Science. 2016 Jan 22;351(6271):400-3. doi: 10.1126/science.aad5725. Epub 2015 Dec 31. PMID: 26721683; PMCID: PMC4760628.
22. Ridler C. CRISPR therapy shows promise in Duchenne muscular dystrophy. Nat Rev Neurol. 2018 Nov;14(11):632-633. doi: 10.1038/s41582-018-0078-8. PMID: 30237553.
23. Burr ML, Sparbier CE, Chan YC, Williamson JC, Woods K, Beavis PA, Lam EYN, Henderson MA, Bell CC, Stolzenburg S, Gilan O, Bloor S, Noori T, Morgens DW, Bassik MC, Neeson PJ, Behren A, Darcy PK, Dawson SJ, Voskoboinik I, Trapani JA, Cebon J, Lehner PJ, Dawson MA. CMTM6 maintains the expression of PD-L1 and regulates anti-tumour immunity. Nature. 2017 Sep 7;549(7670):101-105. doi: 10.1038/nature23643. Epub 2017 Aug 16. PMID: 28813417; PMCID: PMC5706633.
24. Chen JS, Ma E, Harrington LB, Da Costa M, Tian X, Palefsky JM, Doudna JA. CRISPR-Cas12a target binding unleashes indiscriminate single-stranded DNase activity. Science. 2018 Apr 27;360(6387):436-439. doi: 10.1126/science.aar6245. Epub 2018 Feb 15. PMID: 29449511; PMCID: PMC6628903.
25. Gootenberg JS, Abudayyeh OO, Lee JW, Essletzbichler P, Dy AJ, Joung J, Verdine V, Donghia N, Daringer NM, Freije CA, Myhrvold C, Bhattacharyya RP, Livny J, Regev A, Koonin EV, Hung DT, Sabeti PC, Collins JJ, Zhang F. Nucleic acid detection with CRISPR-Cas13a/C2c2. Science. 2017 Apr 28;356(6336):438-442. doi: 10.1126/science.aam9321. Epub 2017 Apr 13. PMID: 28408723; PMCID: PMC5526198. |
|
 /3
/3 