金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
免疫组化(IHC)是一种重要的评估工具,属于免疫染色技术的范畴,利用抗原-抗体结合来研究感兴趣的组织中目标分子的状态。IHC与显微镜和图像分析技术相结合,已经成为一个非常强大的工具,利用对抗原特异性的标记抗体,提供组织抗原的直接可视化。由于这种技术的多功能性、简单性和廉价性,IHC现在是组织学、病理学、癌症生物学、神经科学和药物发现领域不可或缺的。
抗体是小的蛋白质分子,由身体的免疫系统自然表达,以应对外来分子(抗原)的进入并帮助中和它。因此,抗体是对潜在有害的外来生物体及其产物的一种防御。抗原-抗体反应的美妙之处在于,每个抗体只对抗原的一部分有特异性,称为表位,不与其他不符合其目标的分子结合,包括人体自身分子。所有的免疫染色技术,包括IHC,都利用了抗原-抗体反应特异性的这一重要特性,以确保从成千上万的不同分子中检测出单一的分子类型(图1)。
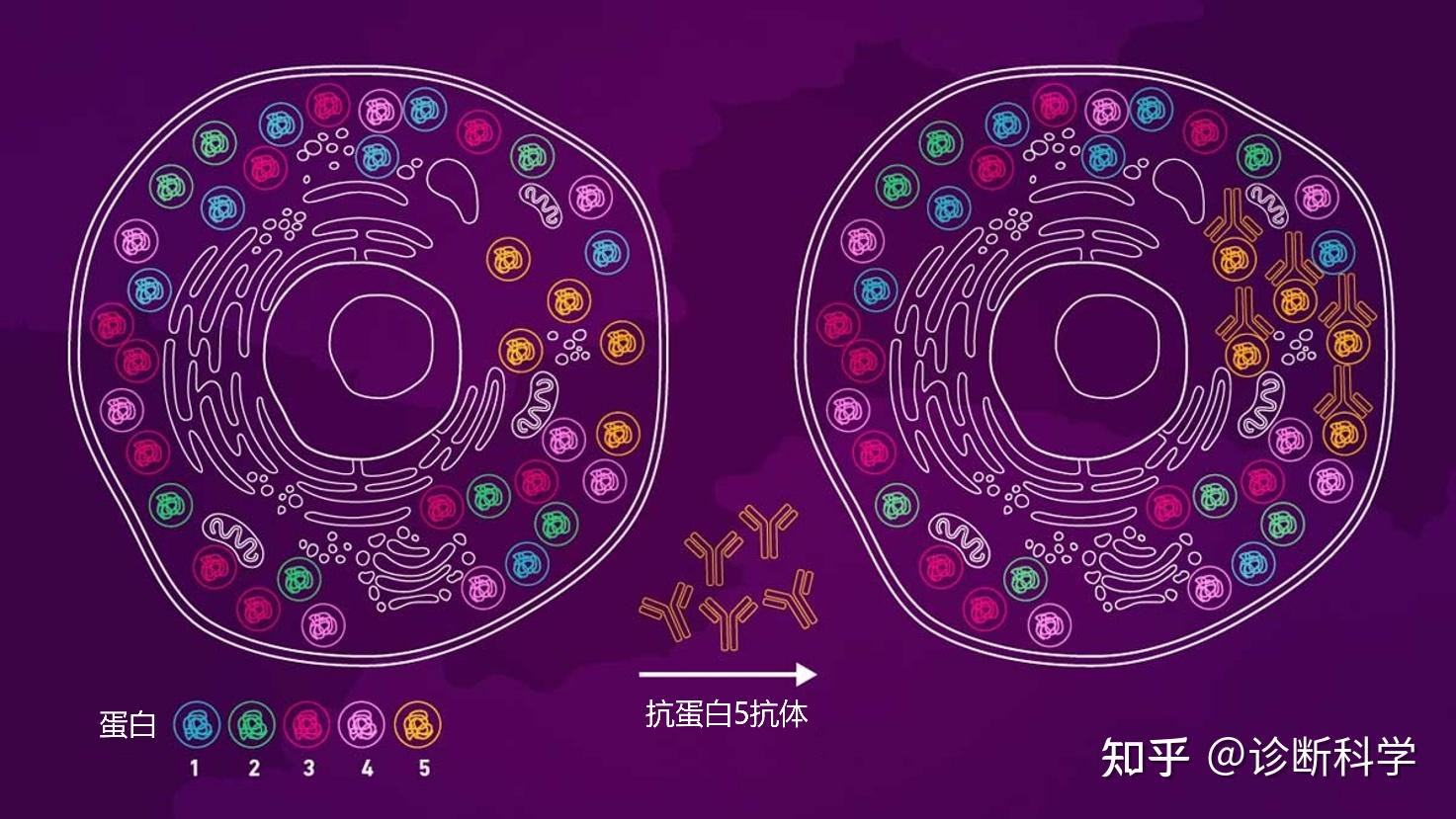
图1 | 抗原-抗体反应的特异性示意图,它能在成千上万的细胞内分子环境中检测和定位一个目标。图中显示对蛋白5的特异性抗体只与蛋白5结合。 如果没有Emil von Behring和Shibasabura Kitasato在1890年发现的抗体,这一重要技术的发展是不可能的[1],但直到1923年,Michael Heidelberger才用标记的抗原检测到抗原-抗体复合物[2]。此后,John Richardson Marrack的工作描述了抗原-抗体反应的性质。Marrack在1934年是第一个将染料附着在抗体上的人[3,4]。1941年,Albert Hewett Coons等人开创了用荧光标签、荧光素标记抗体并检测细胞和组织中各自的抗原[5],并启动了免疫染色革命[6]。此后,该技术得到了很大的发展和改进,已经成为发现和诊断的重要工具。
什么是免疫组织化学(IHC)?
IHC采用了组织学、解剖学、免疫学和生物化学的结合来检测组织内特定目标的数量、分布和定位。针对感兴趣的分子(通常是一种蛋白质)的抗体是在不同物种的生物体中产生的,通常被标记或由另一组标记的抗体辅助。组织样本按照专门的技术准备,以使抗体进入,并使用光镜或电子显微镜检测标签(图2)。
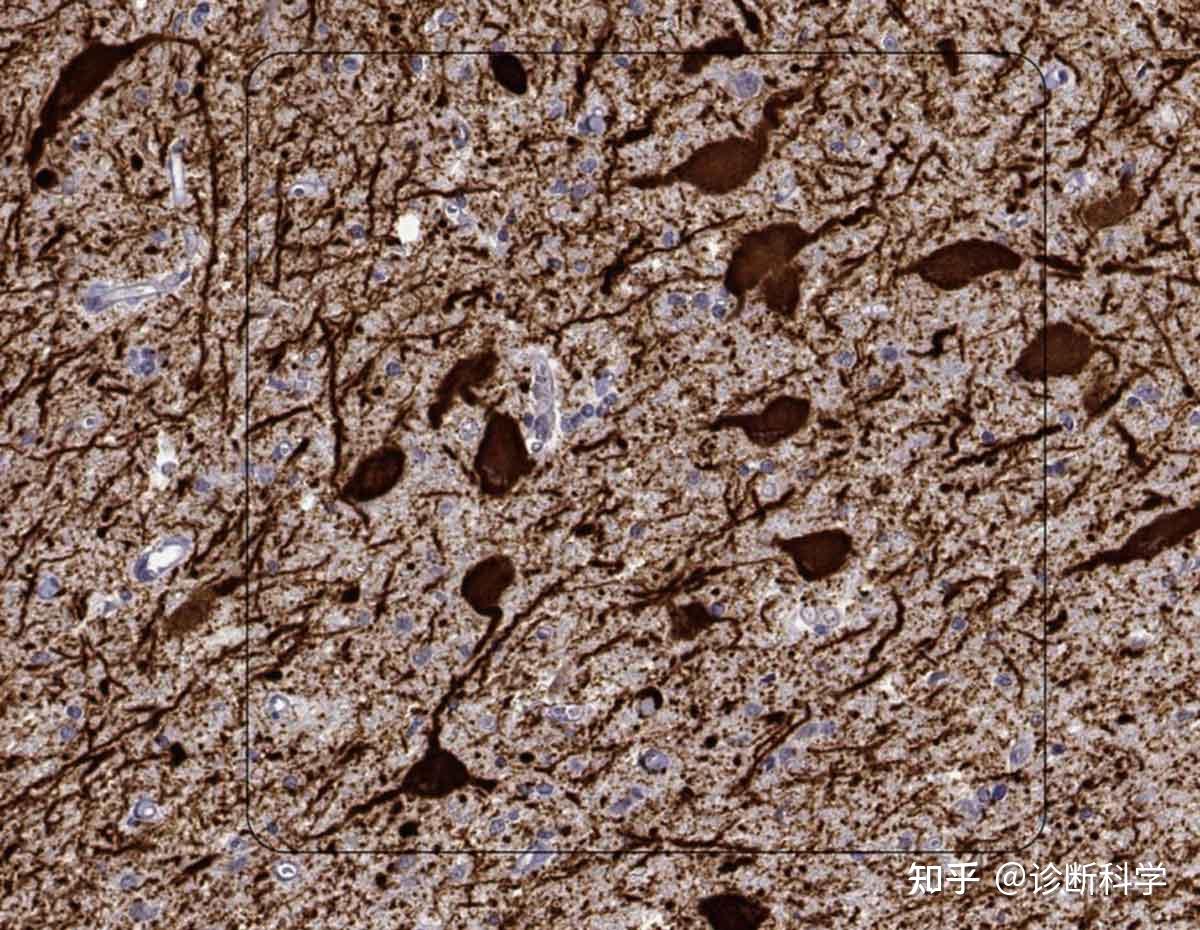
图2 | 色氨酸羟化酶2的免疫组化染色,显示了人类背侧剑突的5-羟色胺能神经元及其突起。 免疫染色与免疫组化染色(IHC染色)的区别是什么?
免疫染色是一个总的术语,包括所有采用抗原-抗体反应检测分子的技术。免疫组化或免疫组化染色是免疫染色的一个具体应用案例,当抗原-抗体反应被用来研究组织(来自希腊语histos,意思是组织)中分子的状态时。
免疫组化与免疫荧光之间有什么区别?
免疫组化和免疫荧光这两个术语是根据免疫染色技术中使用的样品类型和检测方法来应用的。免疫组化是指评估组织中的目标抗原,其检测方法可以是色原性或荧光性的。另一方面,免疫荧光既可指对细胞和组织中的目标抗原进行评估,又特别涉及荧光标签(荧光基团)的检测(图3)。
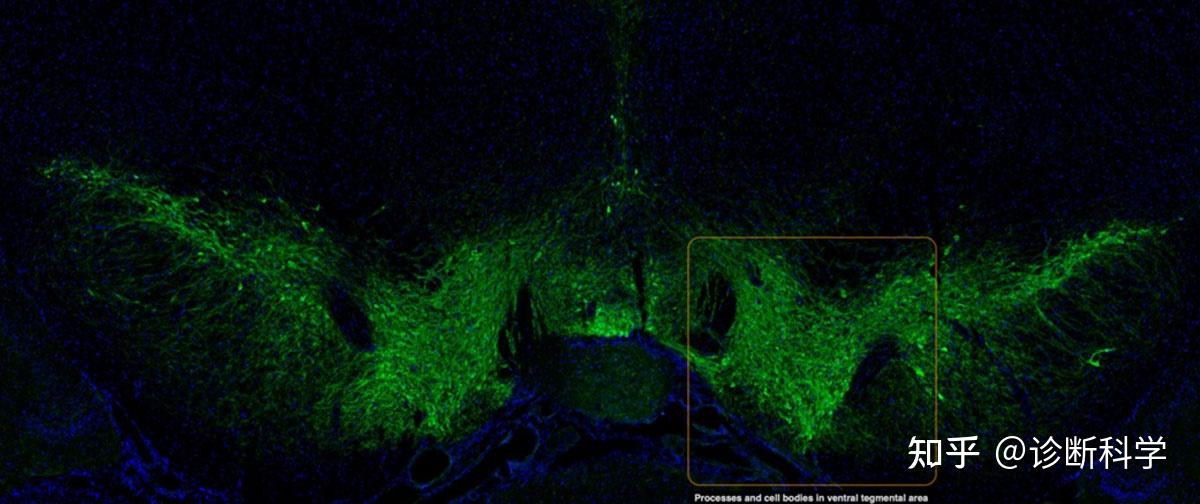
图3 | 酪氨酸羟化酶的免疫荧光显示了小鼠中脑的多巴胺能神经元。 免疫细胞化学与免疫组织化学的区别是什么?
免疫组化涉及研究组织样本中抗原的状态,而免疫细胞化学指的是当感兴趣的样本是培养中的细胞(来自希腊语cyto,意思是细胞)时的免疫染色。
免疫组织化学是如何工作的?
免疫组化的成功取决于多个参数。因此,科学的方法和精心的实验设计是获得可靠和可重复数据的关键。
简要介绍一下所涉及的步骤[7],IHC是在从被研究的生物体中获得的薄薄的组织切片上进行的。然后对这些组织切片进行处理,使其能够进入与感兴趣的抗原特异性结合的抗体。通常情况下,二级抗体将被应用,与一级抗体特异性结合并进行检测。在发色剂检测方法中,二级抗体被标记为一种催化发色剂反应的酶。在免疫荧光检测方法中,二级抗体被标记了一个荧光团,可以在荧光显微镜下直接观察。
现在让我们考虑一下进行IHC时需要考虑的不同参数。
组织:组织的来源,即研究的生物体的种类和感兴趣的器官,将决定如何采集和准备切片的组织。在进行实验之前,必须参考与特定生物体有关的文献,以了解收获组织的技术和进行IHC时必须采取的特别注意。此外,需要注意的是,在固定之前,所有的组织必须在低温条件下快速处理,以防止快速腐烂和干燥。
目标:目标的水平和亚细胞定位在IHC实验设计中极为重要。例如,一个表达量较高的蛋白可以不费吹灰之力就能检测到,用一个标记有荧光体的一级抗体就足以检测。然而,检测含量较少的目标则需要信号放大的方法。目标在细胞内的定位直接影响到所需的通透程度。因此,虽然核蛋白需要更严厉的基于表面活性剂的透化处理,但细胞质成分可以用相对温和的处理来检测。细胞内膜蛋白的检测可仅通过冻融处理实现[8]。
表位:表位是抗原的小的三维表面区域,抗体会特异性地与之结合。重要的是,在IHC过程中,抗体所结合的表位在加入抗体的时候是暴露的。在组织处理过程中,可能被抗体识别的表位有时会被掩盖,可能需要采取一些步骤,如抗原检索,以暴露出表位。
固定方法:固定是指通过固定目标使组织形态和细胞结构保持在固定状态。它可以防止组织变性并实现长期储存。通常情况下,在收获后不久,将组织浸泡在适当的固定剂中数小时,然后再进一步处理进行切片。为了尽量缩短组织采集和固定之间的时间,并实现均匀的固定,在动物模型(如啮齿类动物)中,经心肌灌注固定剂是首选的固定方法。
固定剂:固定剂的选择和固定时间取决于所关注的组织和抗原,需要优化[9,10]。不充分的固定可能会导致组织形态受损,而长时间的固定则会导致抗原的掩盖。固定剂分为三类:醛类(甲醛和戊二醛)、醇类(甲醇和乙醇)和丙酮基固定剂。最常用的固定剂是在磷酸盐缓冲盐水(PBS)中制备的4%(w/v)多聚甲醛溶液。
样品制备方法:样品制备包括将固定的组织块嵌入基质中,使组织能够被切成厚度均匀的切片。这一步骤需要仔细进行,以确保组织在选择的基质中正确排列。两种常见的样品制备方法是福尔马林固定石蜡包埋(FFPE)和冷冻。福尔马林固定法涉及到组织样本的脱水,然后逐渐嵌入石蜡中。冷冻包括在将样本嵌入最佳切割温度(OCT)化合物之前使用蔗糖对其进行冷冻保存。一旦组织片被石蜡包埋或冷冻,它们就可以在适当的条件下保存较长时间。
切片方法:IHC是在组织的薄片上进行的。切片的厚度和均匀性对于确保抗体的有效渗透和组织的正确成像非常重要。FFPE组织通常在室温下用切片机进行切片,而冷冻组织则在零度以下的低温下进行切片。切片可以沿着组织的冠状面、矢状面或侧面获得。然后将切片安装在带正电的载玻片上,确保切片在整个IHC过程中被固定住。
组织切片的预处理:一旦组织切片准备好了,就可以对其进行处理,以利于抗体的渗透,促进免疫原性反应。虽然FFPE切片需要使用有机溶剂(如二甲苯)进行脱石蜡处理,然后再进行复水步骤,但OCT复合包埋切片可以直接用于下游处理。由于冷冻切片的处理步骤较少,这种方法对蛋白质的检测更加灵敏。然而,FFPE提供了良好的形态学保存,并有助于实现更薄的切片(薄至2微米)。
抗原检索方法:基于甲醛的固定往往会导致抗原表位的掩盖。因此,需要进行抗原检索,以去除表位,使其可用于抗体结合,并且经常进行抗原检索[11]。这一步骤在对FFPE组织进行IHC时很重要,但对冷冻组织切片来说可能过于苛刻,可以省略。抗原检索可以通过加热(热诱导表位检索:HIER)或在适当的缓冲液中通过酶降解(蛋白酶诱导表位检索:PIER)来实现。
渗透:渗透是重要的第一步,使组织中的细胞质膜变得多孔,从而允许IHC试剂和抗体进入。通常情况下,表面活性剂如Triton X-100、Tween-20、皂素和地黄素被用来实现通透性。然而,为了更温和地透化以保存细胞内膜,可将切片进行冻融处理。固定剂,如甲醇和丙酮,也能使组织透化,当使用这些固定剂时,可以省略这一步骤。表面活性剂的浓度和孵化时间是根据所使用的固定剂、组织切片的厚度和感兴趣的抗原的亚细胞定位等因素决定的。
阻断缓冲液:尽管抗体与抗原的结合可以非常特异,但由于各种分子内力的作用,一些抗体可能会粘附在某些非特异性的细胞成分上。在加入抗体前在阻断缓冲液中孵化有助于防止抗体在组织中的非特异性结合。常用的阻断剂是正常血清和牛血清白蛋白。当使用发色剂检测时,还需要阻断内源性酶的活性,可以通过使用过氧化氢阻断内源性过氧化物酶活性或左旋咪唑阻断内源性碱性磷酸酶活性来实现。
检测方法:对目标抗原的检测可以是直接的,即标签直接附着在一级抗体上,或者是间接的,即标签或催化发色反应的酶附着在二级抗体上。此外,可以采用信号放大的方法来提高信号检测的灵敏度。
一级抗体:直接与感兴趣的抗原表位结合的抗体被称为一级抗体。一级抗体的选择是IHC实验设计的一个重要步骤[12],人们需要确保所选择的抗体对所研究的物种是特异性的。对目标抗原的抗体的特异性也需要进行彻底评估。一级抗体可能是多克隆或单克隆的:多克隆抗体由多个独立的抗体分子组成,可以识别同一目标的不同表位,而单克隆抗体都识别相同的单一表位。一级抗体的浓度需要通过仔细的实验来确定,以达到最佳效果。
二级抗体:二级抗体是识别一级抗体的抗体,从而能够检测到目标抗原。二级抗体通常被标记为一种酶,以促进信号的放大,用于发色检测,或者它们可能被标记为一种荧光体。
信号放大:对于低水平表达的目标抗原,可能需要进行信号放大以提高该技术的灵敏性。使用的几种信号放大策略包括:阿维菌素-生物素复合物(ABC)方法、标记的链霉菌素-生物素(LSAB)方法和泰拉米信号放大(TSA)[13]。
标签:用于检测目标抗体的标签附着在一抗或二抗上,可以是荧光性的(如免疫荧光),也可以是发色性的。荧光性标签,如荧光素和四甲基罗丹明(TAMRA),可以在荧光显微镜下直接观察。色素法是指在抗体连接的酶,如辣根过氧化物酶(HRP)或碱性磷酸酶(AP)的存在下,将发色底物,如3,3'-二氨基联苯胺(DAB)和5-溴-4-氯-3-吲哚基-磷酸(BCIP)/硝基蓝四氮唑(NBT),转化为彩色产物。
反染:组织通常用二级核或细胞质染色剂来标记所有的细胞,并帮助将IHC标记的细胞与组织的一般形态对照起来,从而提供一种对比。与染色IHC标签一起使用的染色剂包括苏木精、核快速红和曙红;而与荧光IHC标签一起使用的染色剂包括4′,6-二氨基-2-苯基吲哚(DAPI)、Hoechst33342和碘化丙啶。
装片:将准备好的组织切片安装在具有适当折射率的介质中,以便于在显微镜下成像,保护荧光标记的切片不被光漂白,并防止切片干燥。常用的装片介质包括DPX、合成树脂和含有抗褪色剂的甘油基装片介质,用于荧光标记的切片。
多重检测:当一个实验需要同时调查一个以上的目标抗原时,就会进行多重检测。荧光标记是多重检测的首选方法,因为有在整个可见光谱和邻近波长范围内发光的标签。在进行多重检测时必须特别注意防止二级抗体的交叉反应。
成像方法:色素标签可以用光学显微镜检测。荧光或共聚焦显微镜可用于检测荧光团。电子显微镜可用于用胶体金颗粒进行免疫组化标记后的成像[14]。
质控:要确定IHC实验结果的真实性,适当的对照是不可缺少的。一个已知目标抗原表达的组织样本可以作为一个阳性对照。同样地,一个已知没有目标抗原的样本可以作为阴性对照。此外,还需要使用抗体对照来验证抗体的特异性[12]。
免疫组化研究方案示例
将所有这些变量放在一起,一个通用的IHC协议将包括以下步骤[15]。(图4)。
- 固定:从生物体内采集目标组织,在4℃下用4%(w/v)甲醛固定16-24小时。
- 样品制备和切片:对于FFPE切片,使用酒精梯度对组织进行脱水,石蜡包埋,获得2-4 mm厚的切片并安装在带电的玻片上。对于冷冻切片,将组织包埋在OCT化合物中,获得4-8 mm厚的切片并安装在带电的玻璃玻片上。
- 脱脂:这个步骤只对FFPE切片进行。玻璃片上的切片在二甲苯中去石蜡化,然后用酒精梯度进行补水。
- 抗原检索:一般来说,HIER是首选,可以通过将切片在柠檬酸盐缓冲液(pH6.0)中的压力锅(压力下3分钟)或微波炉(20分钟)中孵化来进行。然后用PBS Tween-20清洗切片两次(2 × 5分钟)。
- 过氧化物酶的阻断:为了阻断内源性HRP活性,切片在室温下用3%(v/v)的过氧化氢溶液孵育15分钟。然后用PBS Tween-20清洗三次(3 × 5分钟)。
- 渗透:这一步是可选的;切片可以在PBS中的0.1%(v/v)Triton X-100中室温下孵化10分钟。在进行下一步之前,用PBS Tween-20清洗切片三次(3 × 5分钟)。
- 阻断:将切片与3-5%(v/v)的正常血清在室温下孵育30分钟,在此过程中产生了二级抗体的同一物种。
- 一级抗体:在室温下将切片与物种匹配的一抗在最佳浓度下孵育1-4小时,或在4℃的水化室中孵育过夜。一级抗体可在PBS或阻断缓冲液中稀释。然后进行两次PBS Tween-20清洗(2 × 5分钟)。
- 二级抗体:然后将切片在PBS中稀释至适当浓度(如1:1000)的生物素化二抗中孵育,在室温下孵育30分钟-1小时。用PBS Tween-20清洗切片三次(3 × 5分钟)。
- 信号放大:然后将切片在PBS中的链霉亲和素-HRP中在室温下孵育30分钟。用PBS Tween-20冲洗切片三次(3 × 5分钟)。
- 色素检测:然后将切片与含有1%(w/v)DAB(250 μL)和0.3%(v/v)过氧化氢(250 μL)的溶液在5 mLPBS中在室温下孵育1-3分钟,直到出现棕色。然后用蒸馏水洗三次(3 × 5分钟)。
- 反染:可将切片在苏木精中孵育1分钟,进行反染色。
- 装片:然后用酒精梯度对切片进行脱水,并安装在DPX中。
- 成像:可使用光学显微镜对切片进行成像。
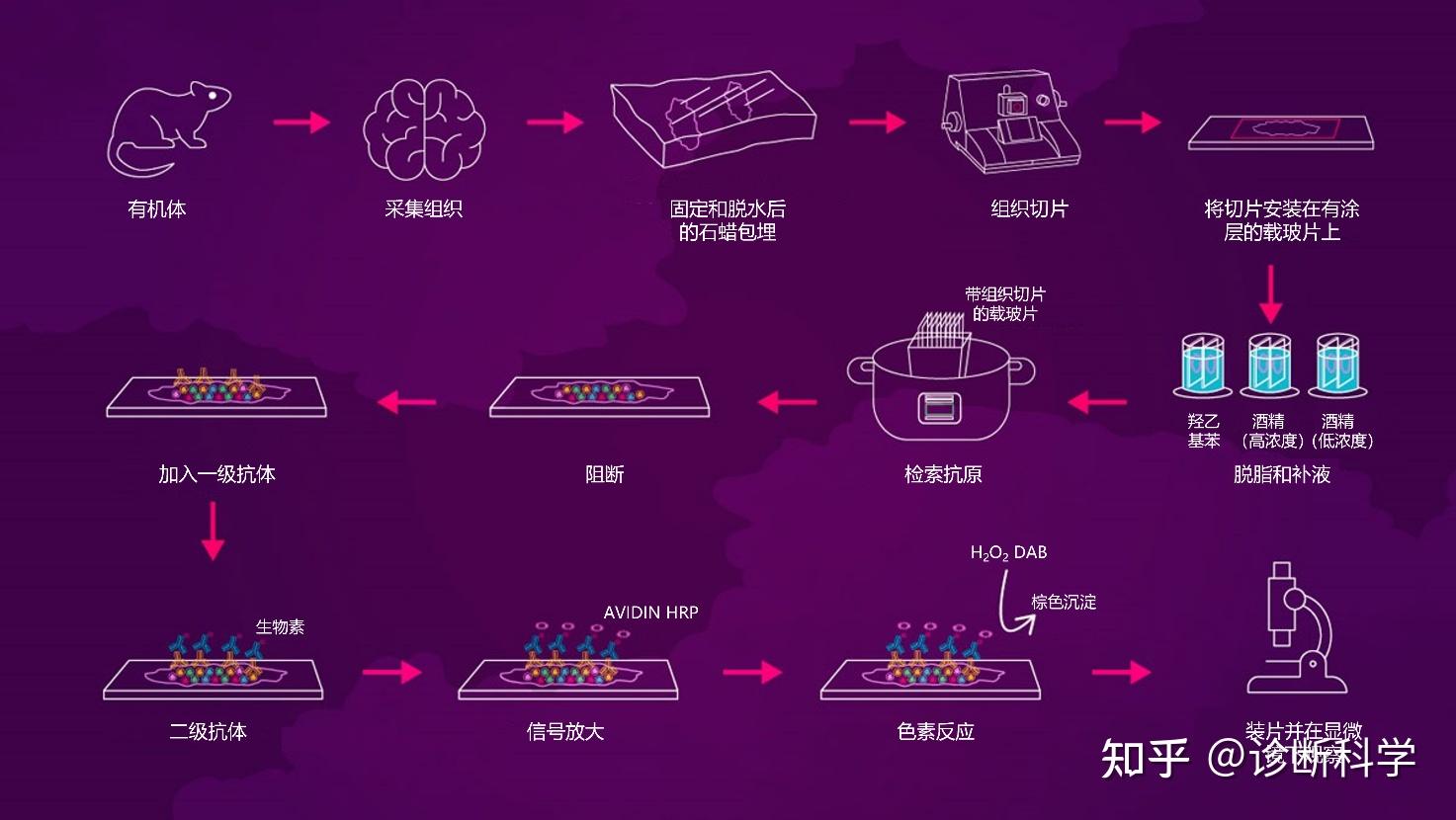
图4 | IHC中涉及的关键步骤,从样品制备到检测和成像。
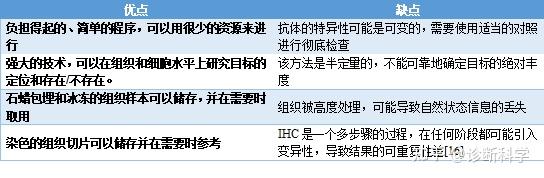
免疫组化分析的优点和缺点
表1总结了IHC的一些主要优点和缺点。
表1 | IHC的优点和缺点。
免疫组化有什么用途?
免疫组化是一种简单且具有成本效益的技术,已成为病理学家和科学家的一个重要工具。这里列出了这种技术的一些应用:
- 肿瘤学中的生物标志物评估:IHC是一种非常流行的工具,用于检测癌症诊断中的生物标志物,以及开发新的生物标志物。IHC可以进行肿瘤检测、分期和分类,此外还可以预测肿瘤的预后和了解肿瘤对治疗模式的反应。基于IHC的生物标志物对乳腺癌[17]、前列腺癌[18]、胰腺癌[19]、肺癌[20]、膀胱癌[21]、结直肠癌[22]和卵巢癌[23]的诊断和治疗已经变得至关重要。
- 感染性疾病的诊断:IHC作为一种重要的工具,用于检测和鉴定感染者组织样本中的病原体抗原,这有助于感染性疾病的治疗[24]。细菌性病原体如巴顿氏菌、耶尔森氏菌、苍白球菌、沙眼衣原体;病毒性病原体如人类疱疹病毒8型(HHV8)、爱泼斯坦-巴尔病毒(EBV)、人类免疫缺陷病毒(HIV);真菌性病原体如白色念珠菌和新型隐球菌var. gattii;以及原生动物病原体,如恶性疟原虫和克鲁斯氏锥虫,都已成功地用IHC鉴定。
- 评估神经退行性疾病:异常的蛋白质构象和聚集可以用IHC鉴定和评估,是许多神经退行性疾病的常规特征,包括阿尔茨海默病(AD)、慢性创伤性脑病(CTE)、进行性核上性麻痹(PSP)、皮克氏病、路易体病、多系统萎缩(MSA)和肌萎缩侧索硬化症(ALS)[25]。
- 人类蛋白质图谱:IHC通过绘制人类蛋白质组图谱,对大数据时代做出了贡献[26]。人类蛋白质图谱[27]是一个免费提供的宝贵资源,它包含了组织水平的表达信息,涵盖了90%的所有蛋白质编码基因。
诊断科学编辑团队收集、整理和编撰,如需更多资讯,请关注公众号诊断科学(DiagnosticsScience)。
参考文献
- Serum Therapy in Therapeutics and Medical Science. The Nobel Prize. https://www.nobelprize.org/prizes/medicine/1901/behring/lecture/. Published December 12, 1901. Accessed June 24, 2022.
- Heidelberger M, Avery OT. The soluble specific substance of pneumococcus: second paper. J Exp Med. 1924; 40(3):301-317. doi:10.1084/jem.40.3.301
- Marrack JR. Nature of antibodies. Nature. 1934;133: 292–293. doi: 10.1038/133292b0
- Marrack JR. The chemistry of antigens and antibodies. J Phys Chem. 1934; 38(7): 989-989. doi:10.1021/j150358a015
- Coons AH, Creech HJ, Jones RN, Berliner E. The demonstration of pneumococcal antigen in tissues by the use of fluorescent antibody. J Immunol. 1942; 45(3): 159-170. https://www.jimmunol.org/content/45/3/159
- Childs GV. History of immunohistochemistry. In: McManus L, Mitchell R eds. Pathobiology of Human Disease: A Dynamic Encyclopedia of Disease Mechanisms. 1st ed. San Diego: Academy Press. 2014: 3775-3796. doi: 10.1016/B978-0-12-386456-7.07401-3
- Magaki S, Hojat SA, Wei B, So A, Yong WH. An introduction to the performance of immunohistochemistry. Methods Mol Biol. 2019;1897:289-298. doi:10.1007/978-1-4939-8935-5_25
- Mardones G, González A. Selective plasma membrane permeabilization by freeze-thawing and immunofluorescence epitope access to determine the topology of intracellular membrane proteins. J Immunol Methods. 2003;275(1-2):169-177. doi:10.1016/s0022-1759(03)00015-2
- Burns JA, Li Y, Cheney CA, et al. Choice of fixative is crucial to successful immunohistochemical detection of phosphoproteins in paraffin-embedded tumor tissues. J Histochem Cytochem. 2009;57(3):257-264. doi:10.1369/jhc.2008.952911
- Paavilainen L, Edvinsson A, Asplund A, et al. The impact of tissue fixatives on morphology and antibody-based protein profiling in tissues and cells. J Histochem Cytochem. 2010;58(3):237-246. doi:10.1369/jhc.2009.954321
- Pileri SA, Roncador G, Ceccarelli C, et al. Antigen retrieval techniques in immunohistochemistry: comparison of different methods. J Pathol. 1997;183(1):116-123. doi:10.1002/(SICI)1096-9896(199709)183:1<116::AID-PATH1087>3.0.CO;2-2
- Ivell R, Teerds K, Hoffman GE. Proper application of antibodies for immunohistochemical detection: antibody crimes and how to prevent them. Endocrinology. 2014;155(3):676-687. doi:10.1210/en.2013-1971
- Dunkenberger L, Del Valle L. Antigen retrieval and signal amplification. Methods Mol Biol. 2022;2422:65-74. doi:10.1007/978-1-0716-1948-3_5
- Faulk WP, Taylor GM. An immunocolloid method for the electron microscope. Immunochemistry. 1971;8(11):1081-1083. doi:10.1016/0019-2791(71)90496-4
- Kim SW, Roh J, Park CS. Immunohistochemistry for pathologists: Protocols, pitfalls, and tips. J Pathol Transl Med. 2016;50(6):411-418. doi:10.4132/jptm.2016.08.08
- O&#39;Hurley G, Sjöstedt E, Rahman A, et al. Garbage in, garbage out: a critical evaluation of strategies used for validation of immunohistochemical biomarkers. Mol Oncol. 2014;8(4):783-798. doi:10.1016/j.molonc.2014.03.008
- Zaha DC. Significance of immunohistochemistry in breast cancer. World J Clin Oncol. 2014;5(3):382-392. doi:10.5306/wjco.v5.i3.382
- Carneiro A, Barbosa ÁRG, Takemura LS, et al. The role of immunohistochemical analysis as a tool for the diagnosis, prognostic evaluation and treatment of prostate cancer: A systematic review of the literature. Front Oncol. 2018;8:377. doi:10.3389/fonc.2018.00377
- Luu TT. Review of immunohistochemistry biomarkers in pancreatic cancer diagnosis. Front Oncol. 2021;11:799025. doi:10.3389/fonc.2021.799025
- Inamura K. Update on immunohistochemistry for the diagnosis of lung cancer. Cancers (Basel). 2018;10(3):72. doi:10.3390/cancers10030072
- Wu J, Wen JM, Wang YC, et al. Prognostic value of an immunohistochemical signature in patients with bladder cancer undergoing radical cystectomy. Front Oncol. 2021;11:641385. doi:10.3389/fonc.2021.641385
- Banias L, Jung I, Bara T, et al. Immunohistochemical-based molecular subtyping of colorectal carcinoma using maspin and markers of epithelial-mesenchymal transition. Oncol Lett. 2020;19(2):1487-1495. doi:10.3892/ol.2019.11228
- Köbel M, Rahimi K, Rambau PF, et al. An immunohistochemical algorithm for ovarian carcinoma typing. Int J Gynecol Pathol. 2016;35(5):430-441. doi:10.1097/PGP.0000000000000274
- Oumarou Hama H, Aboudharam G, Barbieri R, Lepidi H, Drancourt M. Immunohistochemical diagnosis of human infectious diseases: a review. Diagn Pathol. 2022;17(1):17. doi:10.1186/s13000-022-01197-5
- Dugger BN, Dickson DW. Pathology of neurodegenerative diseases. Cold Spring Harb Perspect Biol. 2017;9(7):a028035. doi:10.1101/cshperspect.a028035
- Sjöstedt E, Zhong W, Fagerberg L, et al. An atlas of the protein-coding genes in the human, pig, and mouse brain. Science. 2020;367(6482):eaay5947. doi:10.1126/science.aay5947
- Uhlén M, Fagerberg L, Hallström BM, et al. Proteomics. Tissue-based map of the human proteome. Science. 2015;347(6220):1260419. doi:10.1126/science.1260419
***
平台 | 欢迎光临,诊断科学的店铺~ |
|
 /3
/3 