金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
1.CRISPR-Cas9结构
CRISPR-Cas9
Clustered regularly interspersed short palindromic repeats
成簇规律间隔短回文重复序列
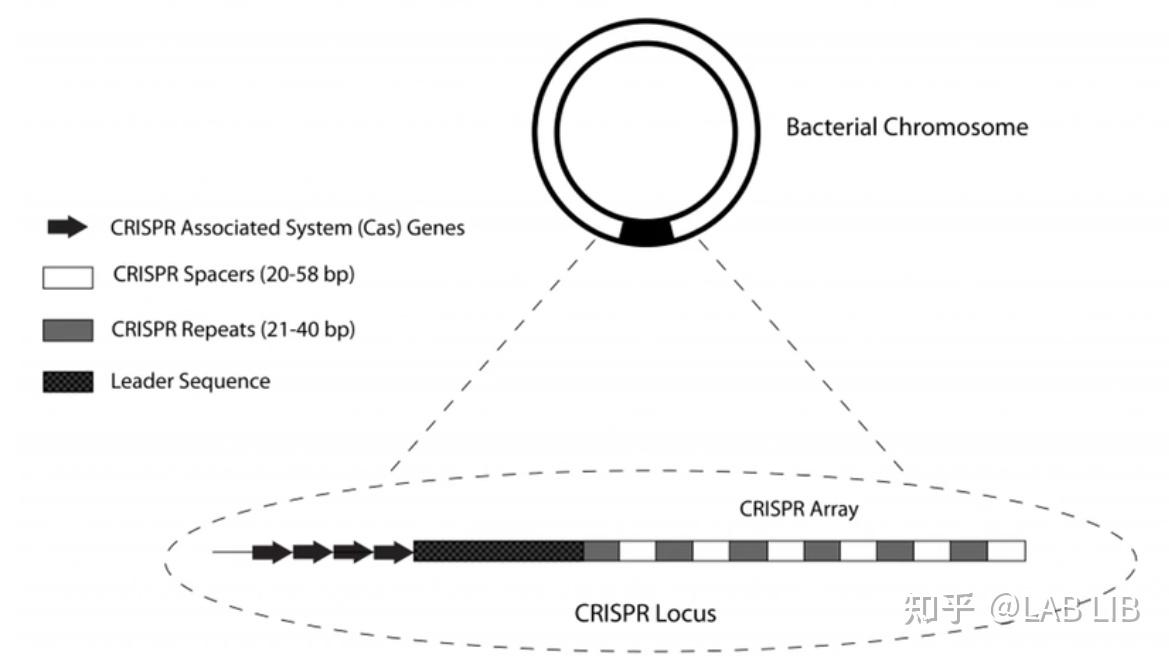
细菌染色体(chromosome of bacteria):由一条环状双链DNA分子组成
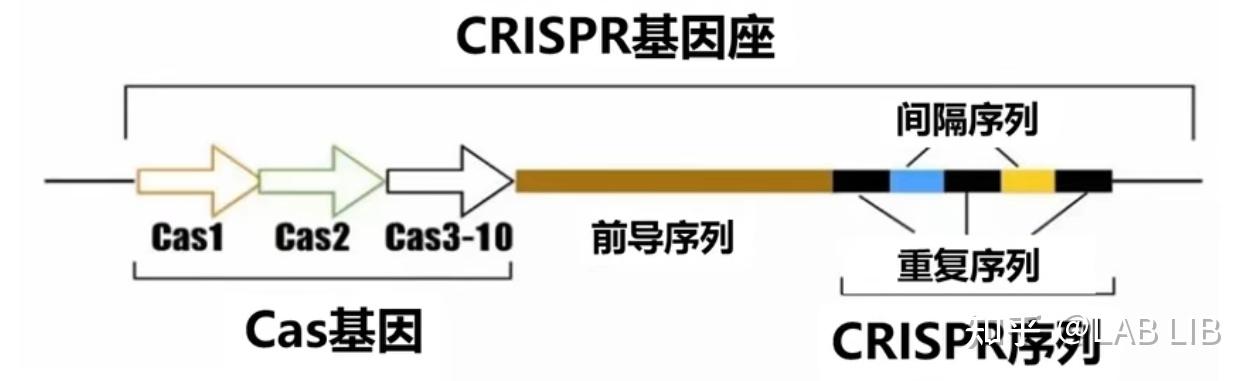
CRISPR序列由众多短而保守的重复序列区 (repeat) 和间隔区 (spacer) 组成。重复序列区含有回文序列,可以形成发卡结构。而间隔区比较特殊,它们是被细菌俘获的外源DNA序列。上游的前导区 (leader) 被认为是CRISPR序列的启动子
CRISPR关联基因 (CRISPR associated,Cas):CRISPR关联基因编码的蛋白均可与CRISPR序列区域共同发生作用
间隔序列(Spacer sequence):靶向序列来自外源基因组入侵
2.CRISPR/Cas系统
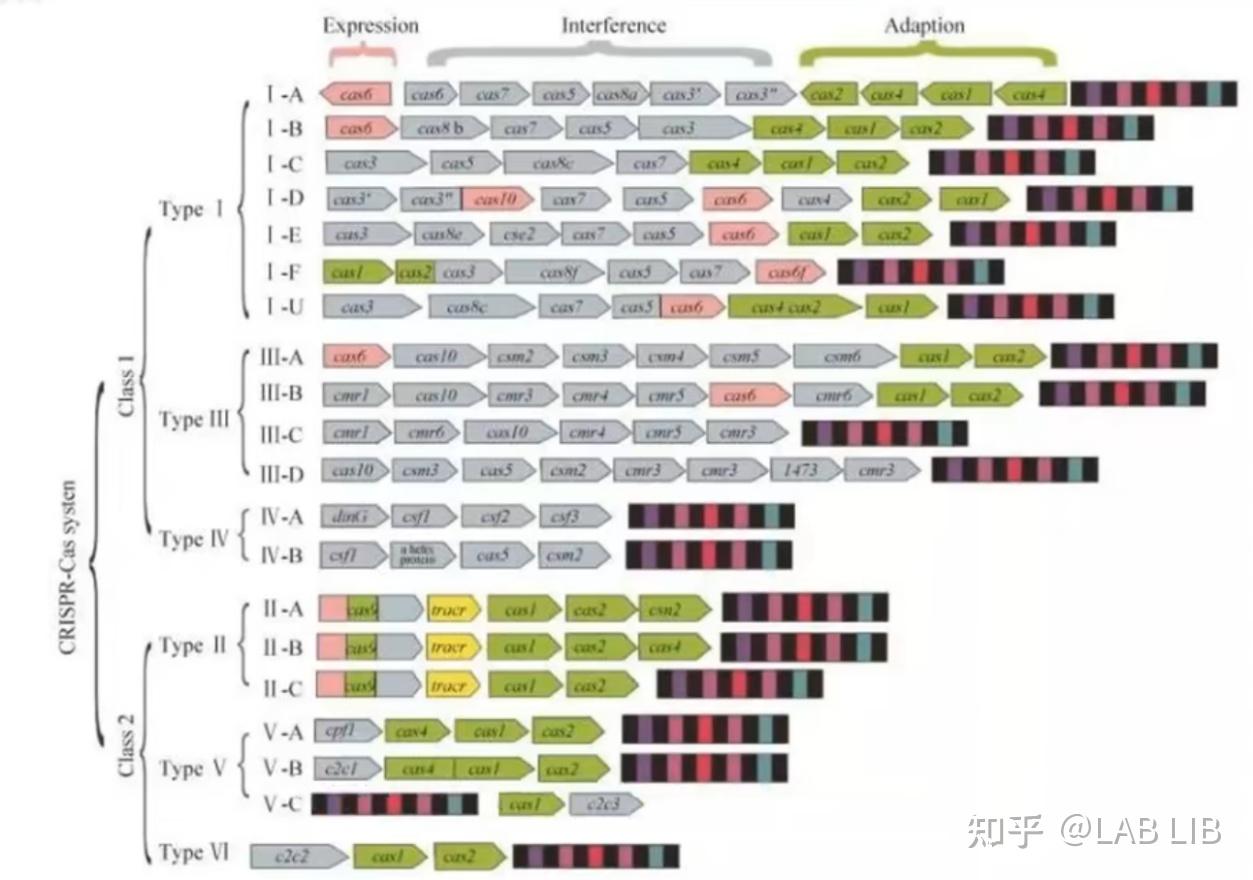
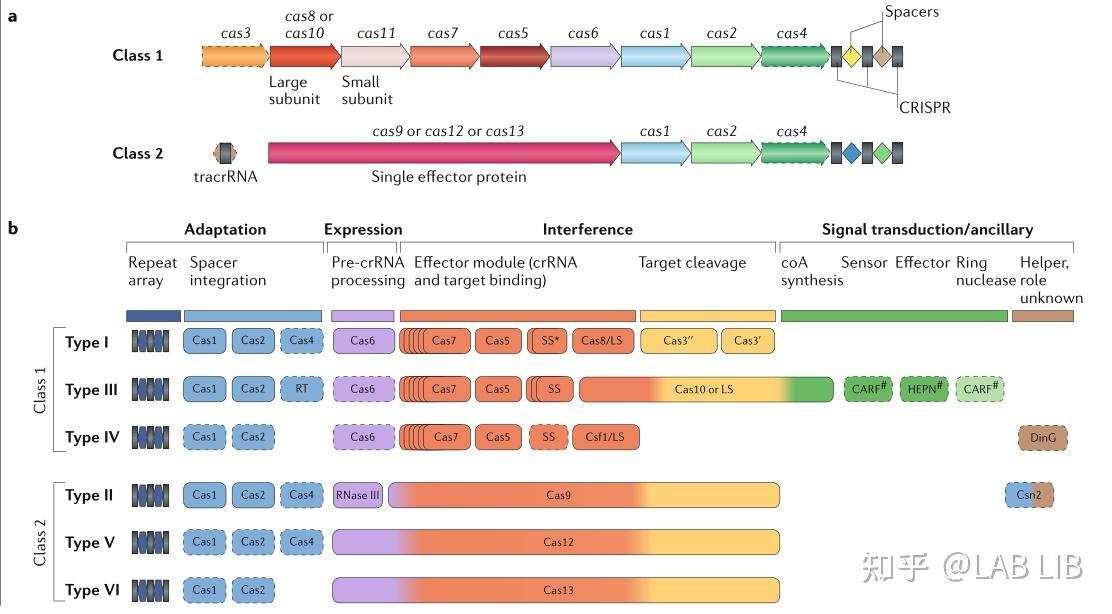
CRISPR/Cas系统可分为两类,每一类包含若干个类型和亚型。
第1类系统是由多个效应蛋白组成的复合物,其中每个蛋白在CRISPR过程中执行单一功能。
第2类系统是又多功能的单一效应蛋白组成。由于其简单而高效,最常用于生物工程和CRISPR诊断。
3.CRISPR-Cas9原理
基本原理:导向RNA介导Cas蛋白结合靶向序列,进行定点基因编辑,引入新突变
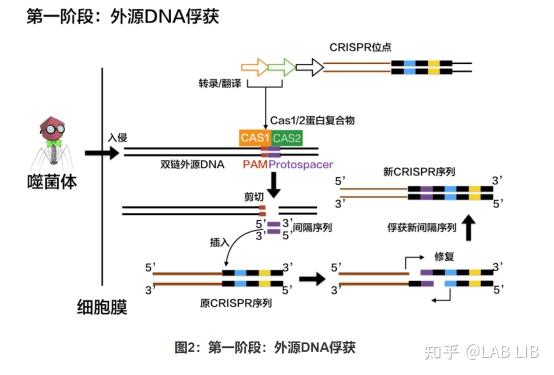
1. 外源DNA的捕获
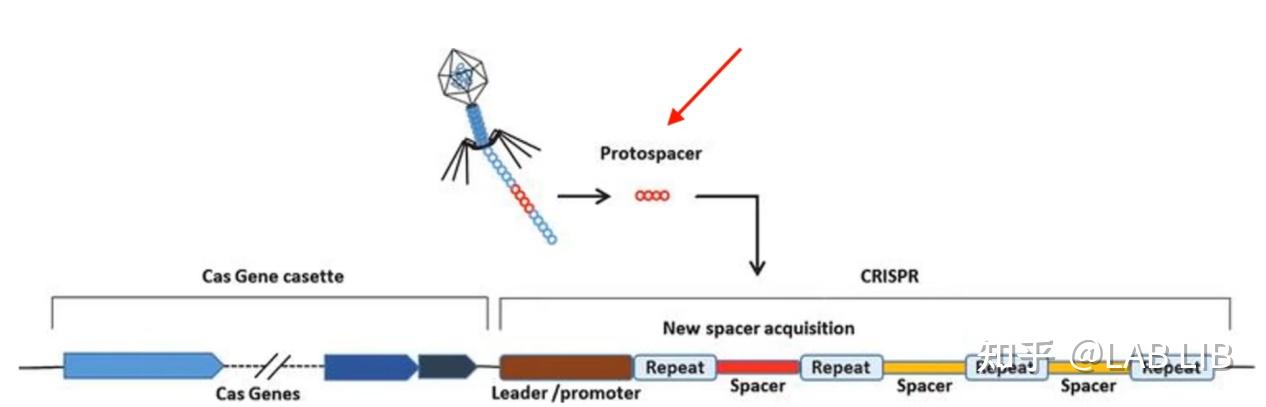
原间隔序列(Protospacer)会被cas1、cas2效应蛋白剪切,插入CRISPR序列的前导序列下游。原间隔序列向两端延伸的几个碱基都十分保守,被Cas1/2识别 称为原间隔序列邻近基序(Protospacer Adjacent Motif)(PAM)位于原间隔序列下游。
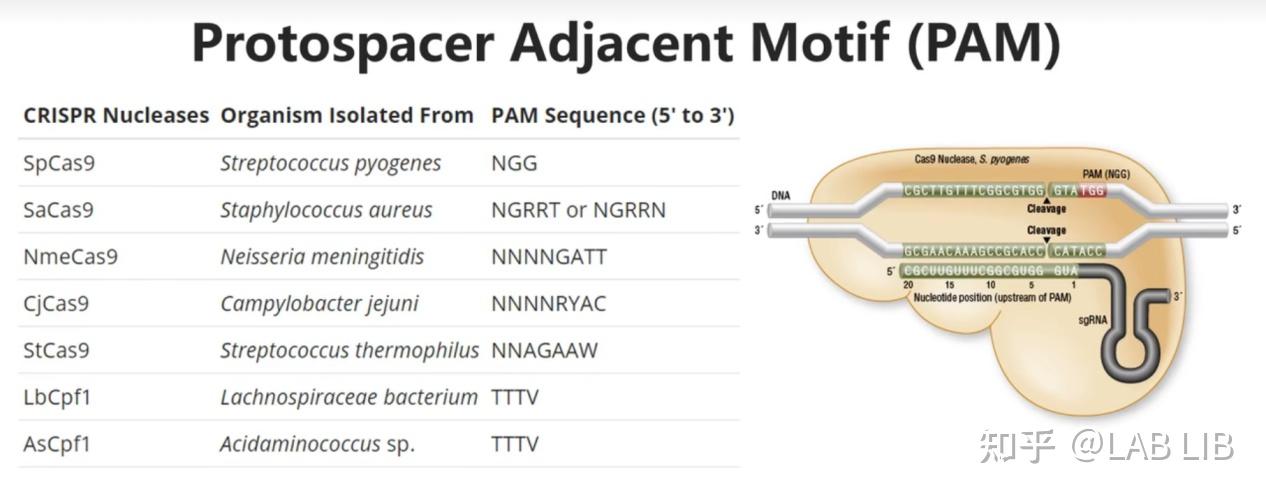
CRISPR组中的DNA与病毒的DNA序列相同,却不含有PAM,所以不会被酶切裂解。通过PAM,细胞可以区分自己的DNA和外来DNA。很特别的一点是,PAM序列的识别是通过效应蛋白本身决定的,不同的效应蛋白识别不同的PAM。
2. crRNA的形成
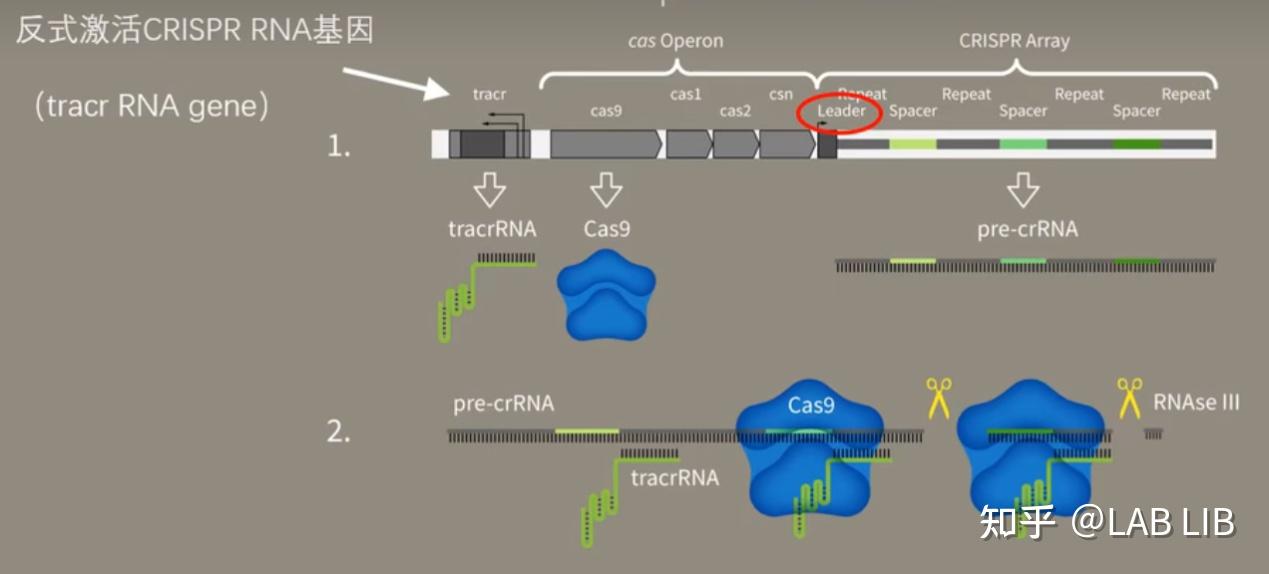
当病毒再次入侵,CRISPR序列会在前导区的调控下转录出pre-CRISPR-derived RNA (pre-crRNA) 和trans-acting crRNA (tracrRNA)。
pre-crRNA是由整个CRISPR序列转录而成的大型RNA分子
tracrRNA基因位于Cas基因上游,转录具有发卡结构的RNA
Single guide RNA(单链向导RNA)(sgRNA):tracrRNA与crRNA互补形成复合物,引导RNAse Ⅲ(RNA酶3)剪切
pre-crRNA-tracrRNA-Cas9蛋白复合物中的pre-crRNA,最终形成一段短小的crRNA (包含单一种类的间隔序列RNA以及部分重复序列区)。
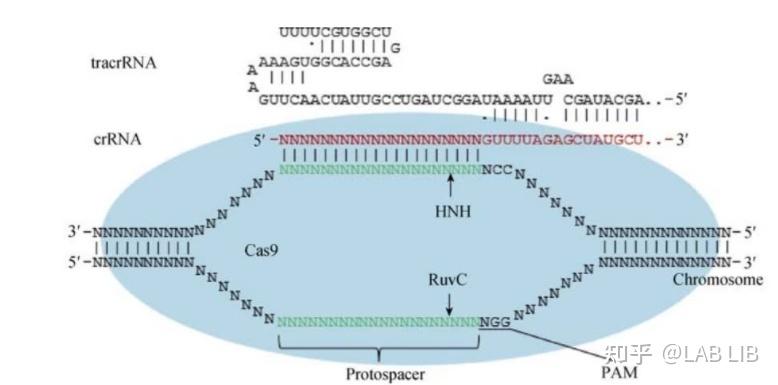
现在人工改造的版本中tracrRNA和crRNA被整合成了一个RNA转录出来,通过碱基配对作用,自折叠成部分双链的RNA结构,与Cas9结合发挥功能。
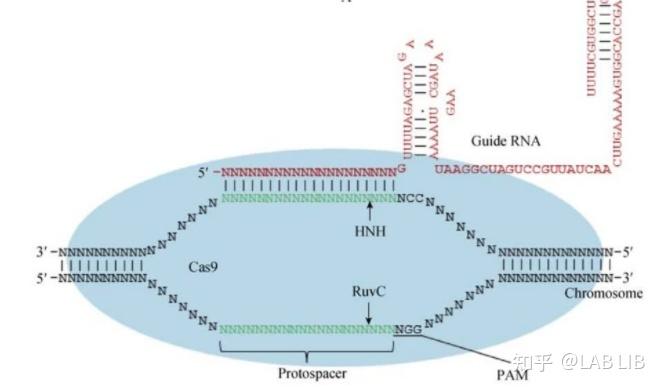
3.对外源基因组的干扰
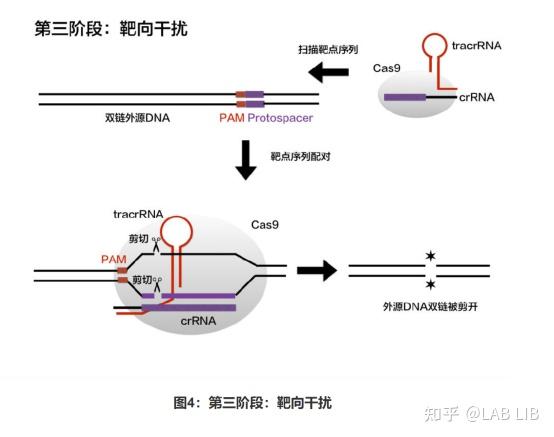
crRNA-tracrRNA-Cas9蛋白复合物(核糖核蛋白监视复合物)(RNP)将扫描整个外源DNA序列,并识别出与crRNA互补的原间隔序列,定位到PAM-原间隔序列的区域,DNA双链将被解开,形成R-Loop。crRNA将与互补链杂交,而tracrRNA保持游离状态。
R环(R-loop)是指当某些基因转录形成mRNA分子难与模版链分离时,会形成RNA-DNA杂交体,这时非模板链与RNA-DNA杂交体共同构成r环结构。
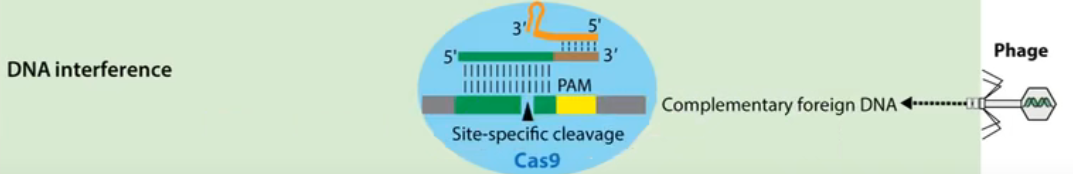
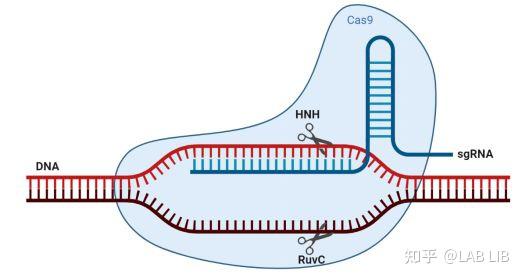
Site-specific cleavage:位点特异性切割
Cas9蛋白HNH酶活性将剪切crRNA互补的DNA链,而其RuvC活性位点将剪切非互补链。切割位点在PAM序列上游第3第4碱基之间。
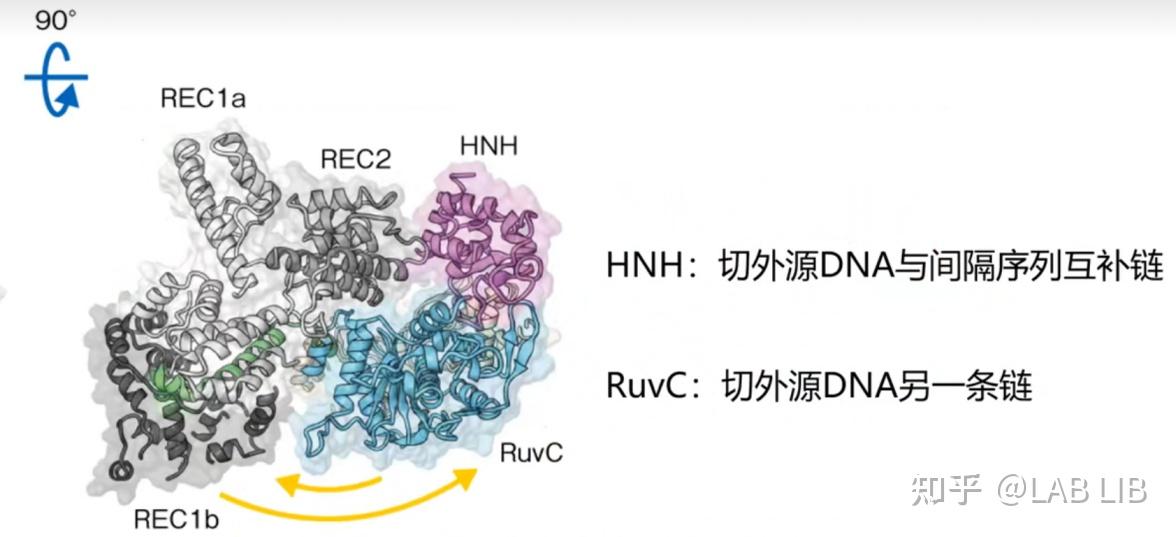
Cas9蛋白的两个催化结构域
RuvC和HNH结构域发挥核酸内切酶的功能;
REC1和REC2结构域的功能是识别与结合,将Cas9蛋白锚定在目标DNA上并沿线移动;
如果对HNH和RuvC活性区域进行突变使之无法行驶剪切的功能的话就会产生Dead Cas9 (dCas9). dCas9 只可以提议性的附着到特定的基因位置上 , 而不可以行驶剪切功能。只对HNH或RuvC的其中一个位点进行沉默突变, 形成Cas9 nickase, 这样就可以用两个不同的Cas9 nickase对基因组进行锚定和单链剪切, 造成粘性末端.
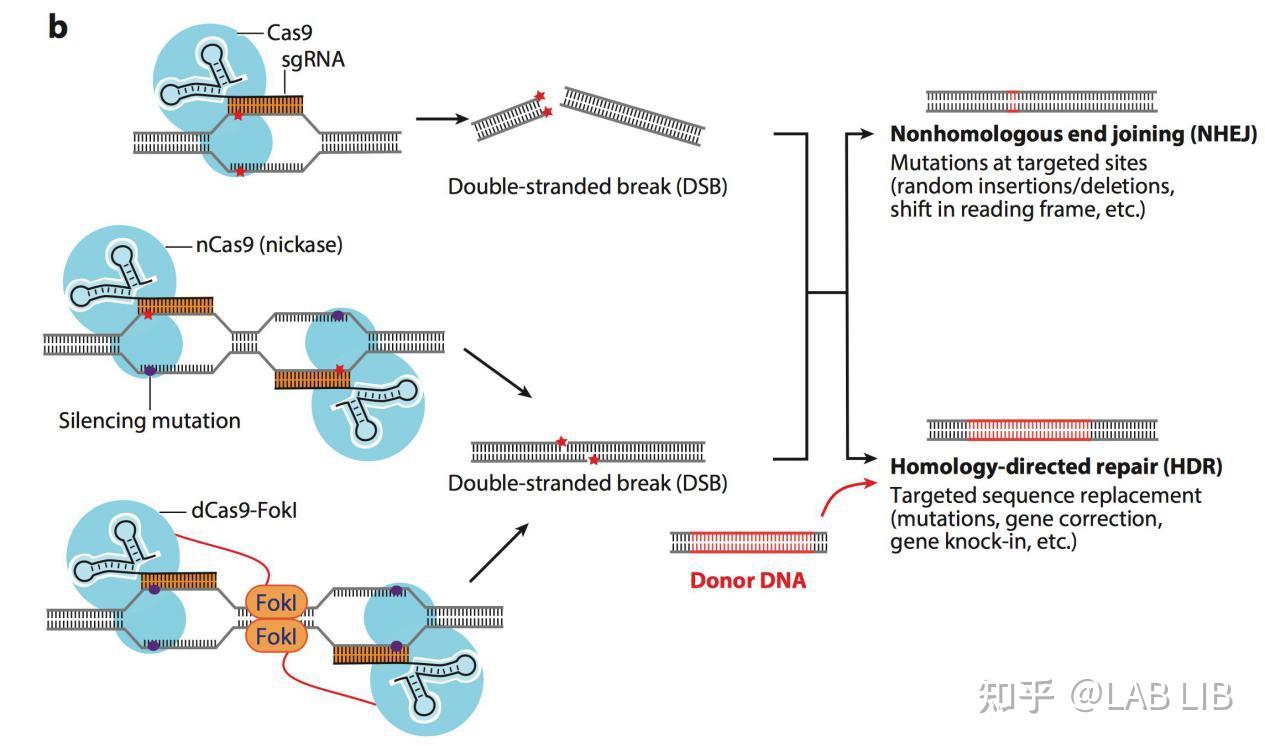
DNA模板(Donor DNA)
4.修复DSB
DSB(Double Strand Breaks):双链DNA断裂
NHEJ(Non-homologous end joining):非同源末端连接
HR(Homologous recombination):同源重组
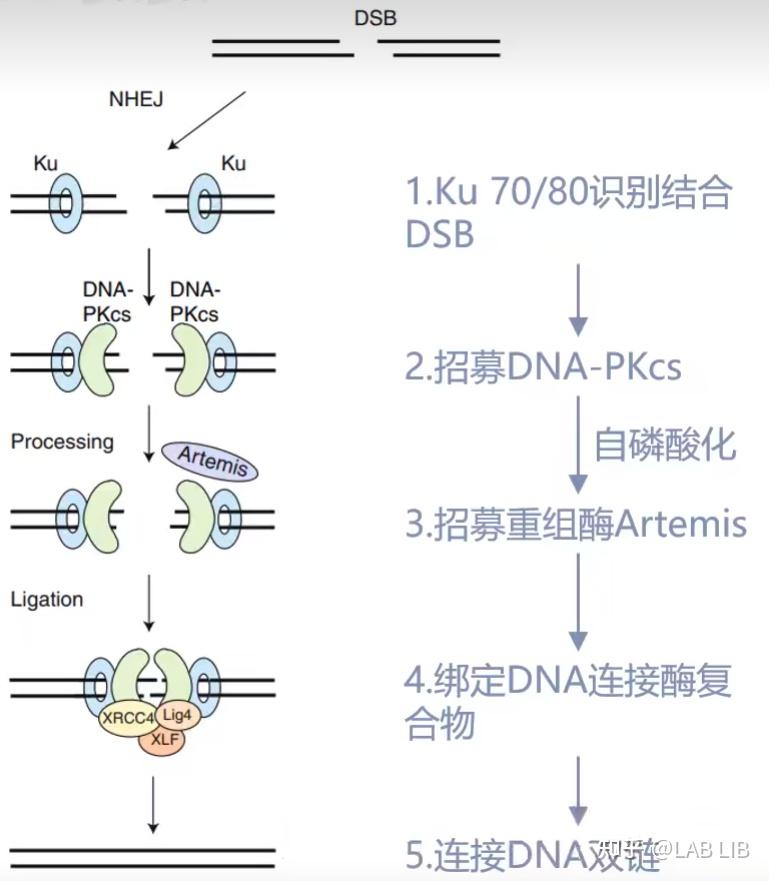
NHEJ, 不同源的末端修复. 这是生物体内自发的SOS修复, 紧急连接断裂的DNA 双链, 但这种连接方法是随机的, 可能造成碱基的插入, 删除, 造成移码突变
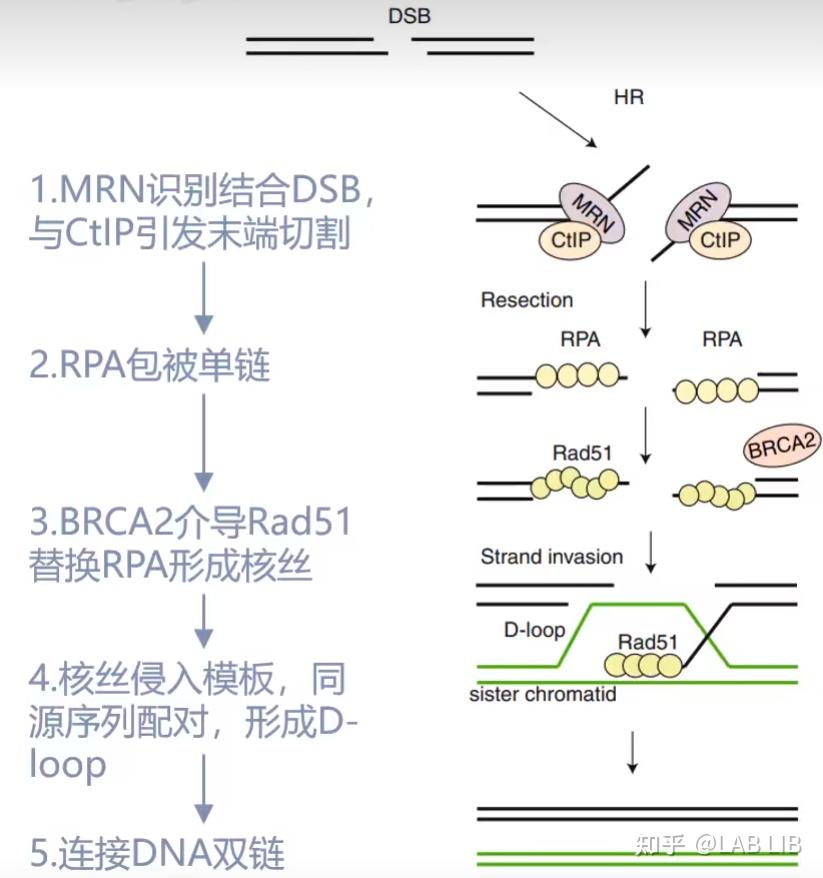
HDR, 同源定向修复, 提供一个两端序列和断裂序列相同的donor DNA小片段, 这个DNA小片段可以与断裂的基因进行同源重组, 由此形成目的性的插入基因, 删除基因等功能,由此可以完成基因组中基因的定向改变, 插入和删除.
5.在真核细胞中使用CRISPR系统
Cas9系统无法使用在高等动物中的原因,仅仅是因为哺乳动物细胞具有细胞核和核膜,RNP(crRNA-cas9复合体)无法进入细胞核对DNA进行切割。张峰的做法是给cas9蛋白添加了SV40 NLS(Nuclear localization sequence),帮助Cas9进入细胞核。
核定位序列(Nuclear localization sequence)或者核定位信号(Nuclear localization signal)——蛋白质的一个结构域,通常为一短的氨基酸序列,它能与入核载体相互作用,使蛋白能被运进细胞核。
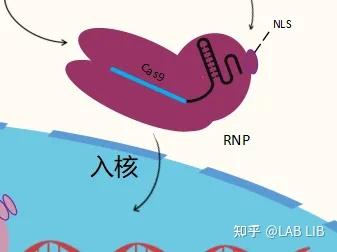
转染:真核细胞主动或被动倒入外源DNA片段而获得新表型。
报告基因:理想情况下,选择的报告蛋白对转染的细胞来说是独一无二的的,只有质粒能表达,很容易被检测出,经常被用于检测转染效率和细胞内的表达水平。
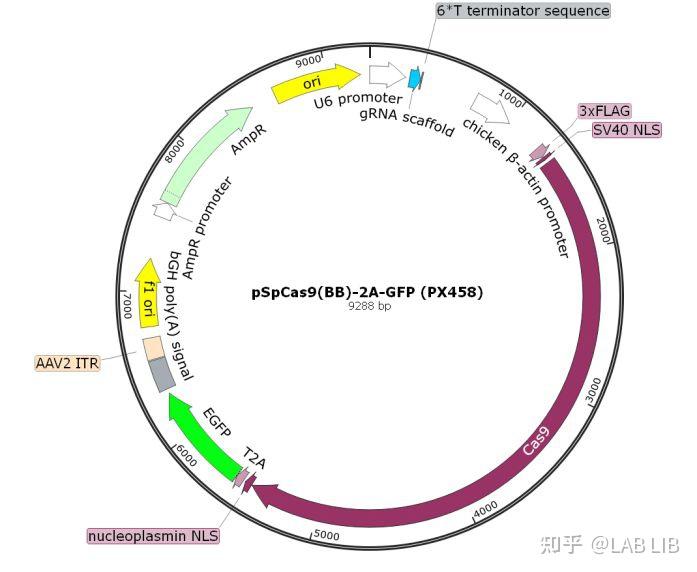
pSpCas9(BB)-2A-GFP (PX458)
以pSpCas9(BB)-2A-GFP (PX458)一个用于CRISPR的质粒为例,其是由一个AAV病毒载体改造而来的真核表达质粒。
Ori是质粒的复制起点(也称origin),ori和它所控制的组分一起称为一个复制子。
U6启动子(U6 promoter):III类启动子,是一个RNA聚合酶III的结合位点,用于启动下游转录,U6启动子遇到连续T碱基(TTTTTT)转录终止。在这里U6启动子后面紧接着的是gRNA scaffold。
gRNA scaffold是化脓性链球菌CRISPR/Cas9系统的gRNA骨架,主要作用是和Cas9蛋白binding,根据sgRNA作用的不同,可以敲减/除。
Cas9:经过哺乳动物密码子优化的Cas9蛋白序列,其前后都加上了NLS入核信号,让其得以在哺乳动物中发挥作用。Cas9的C端加上T2A标签,标签后可接EGFP(增强绿色荧光蛋白)或其他筛选基因,让Cas9和标签非融合表达。T2A可将Cas9蛋白的表达和EGFP断开。EGFP可用于指示质粒转染的成功。2A是一个断裂信号,但断裂并不是百分之百的。
U6启动子引导了sgRNA的表达,紧接着CBV启动子联合Kozak序列,使得Cas9在脊椎动物中表达,sgRNA和Cas9在同一个质粒中被转录,从而完整了CRISPR/Cas9系统,同时SV40 NLS的存在会将sgRNA-Cas9复合物传递到细胞核中,由于Cas9蛋白很大,Cas9蛋白后面再次连接了一个NLS信号,以确保sgRNA-Cas9的和定位,基因编辑得以发生。
CRISPR/Cas9可以构建在慢病毒系统、腺病毒、腺相关病毒(AAV)系统上,不过由于Cas9基因已经超过了4000bp长度,超过了一些病毒的承载范围,所以其病毒包装效率会受到不同程度的影响。
sgRNA和Cas9蛋白同在一个质粒上的系统,我们称为all in one系统,其优点在于操作简单便捷,但过多的元件也导致质粒太大,影响转染和病毒包装效果(尤其是AAV病毒)。所以,也可以将sgRNA和Cas9分别设计在不同的质粒上,这样的话,对病毒包装滴度有一定的正面作用,但相对的,需要将Cas9 和sgRNA分别转染,操作会复杂一些。
6.CRISPR/Cas9的脱靶
因Cas9 sgRNA的靶序列仅有20bp,所以sgRNA很容易结合到和靶序列相似的序列上,并对非靶序列进行切割,这称为脱靶,不论哪种CRISPR系统,都存在sgRNA序列不完全匹配但能够结合基因组的脱靶现象,CRISPR定位到脱靶位点引发序列改变,引入额外的基因损伤。
接近PAM端,对sgRNA序列的特异性要求就越高,当sgRNA近PAM端序列不匹配时,切割活性会大大降低;sgRNA有三个以上不匹配碱基时,切割活性基本上消失;当sgRNA在远离PAM端和靶序列不匹配时,仍然会有切割活性。
在sgRNA设计阶段需要如何做才能够尽可能地避免脱靶现象的发生。最简单的脱靶位点检测方法是全基因组测序(WGS)。常见的脱靶位点检测技术都需要对脱靶位点进行捕获富集,来提高检测灵敏度,降低测序成本。按照实验原理的不同,脱靶位点检测技术可以分为细胞外、细胞内和其他特殊方法这3类。
7.常见应用
1、基因敲除(Knock-out)
Cas9可以对靶基因组进行剪切,形成DNA的双链断裂。在通常情况下,细胞会采用高效的非同源末端连接方式(NHEJ)对断裂的DNA进行修复。但是,在修复过程中通常会发生碱基插入或缺失的错配现象,造成移码突变,(移码突变:是指DNA分子由于某位点碱基的缺失或插入,引起阅读框架变化,造成下游的一系列密码改变,使原来编码某种肽链的基因变成编码另一种完全不同的肽链序列。)使靶标基因失去功能,从而实现基因敲除。为了提高CRISPR系统的特异性,可将Cas9的一个结构域进行突变,形成只能对DNA单链进行切割造成DNA缺口的Cas9 nickase核酸酶。因此想要形成双链断裂的效果可以设计两条sgRNA序列,分别靶向DNA互补的两条链,这样两条sgRNA特异性的结合靶标序列,即可形成DNA断裂,并在修复过程中通过移码突变实现基因敲除
2、基因敲入(Knock-in)
当DNA双链断裂后,如果有DNA修复模板进入到细胞中,基因组断裂部分会依据修复模板进行同源重组修复(HDR),从而实现基因敲入。修复模板由需要导入的目标基因和靶序列上下游的同源性序列(同源臂)组成,同源臂的长度和位置由编辑序列的大小决定。DNA修复模板可以是线性/双链脱氧核苷酸链,也可以是双链DNA质粒。HDR修复模式在细胞中发生率较低,通常小于10%。为了增加基因敲入的成功率,目前有很多科学家致力于提高HDR效率,将编辑的细胞同步至HDR最活跃的细胞分裂时期,促进修复方式以HDR进行;或者利用化学方法抑制基因进行NHEJ,提高HDR的效率
3、基因抑制、基因激活(Repression or Activation)
Cas9的特点是能够自主结合和切割目的基因,通过点突变的方式使Cas9的两个结构域RuvC-和HNH-失去活性,形成的dCas9只能在sgRNA的介导下结合靶基因,而不具备剪切DNA的功能。因此,将dCas9结合到基因的转录起始位点,可以阻断转录的开始,从而抑制基因表达;将dCas9结合到基因的启动子区域也可以结合转录抑制/活化物,使下游靶基因转录受到抑制或激活。因此dCas9与Cas9、Cas9 nickase的不同之处在于,dCas9造成的激活或者抑制是可逆的,并不会对基因组DNA造成永久性的改变。
4、多重编辑(Multiplex Editing)
将多个sgRNA质粒转入到细胞中,可同时对多个基因进行编辑,具有基因组功能筛选作用。多重编辑的应用包括:使用双Cas9nickases提高基因敲除的准确率、大范围的基因组缺失及同时编辑不同的基因。通常情况下,一个质粒上可以构建2~7个不同的sgRNA进行多重CRISPR基因编辑。
5、功能基因组筛选
利用CRISPR-Cas9进行基因编辑可以产生大量的基因突变细胞,因此利用这些突变细胞可以确认表型的变化是否是由基因或者遗传因素导致的。基因组筛选的传统方法是shRNA技术,但是shRNA有其局限性:具有很高的脱靶效应以及无法抑制全部基因而形成假阴性的结果。CRISRP-Cas9系统的基因组筛选功能具有高特异性和不可逆性的优势,在基因组筛选中得到了广泛的应用。目前CRISPR的基因组筛选功能应用于筛选对表型有调节作用的相关基因,如对化疗药物或者毒素产生抑制的基因、影响肿瘤迁移的基因以及构建病毒筛选文库对潜在基因进行大范围筛选等。
6、激活或抑制转录反应
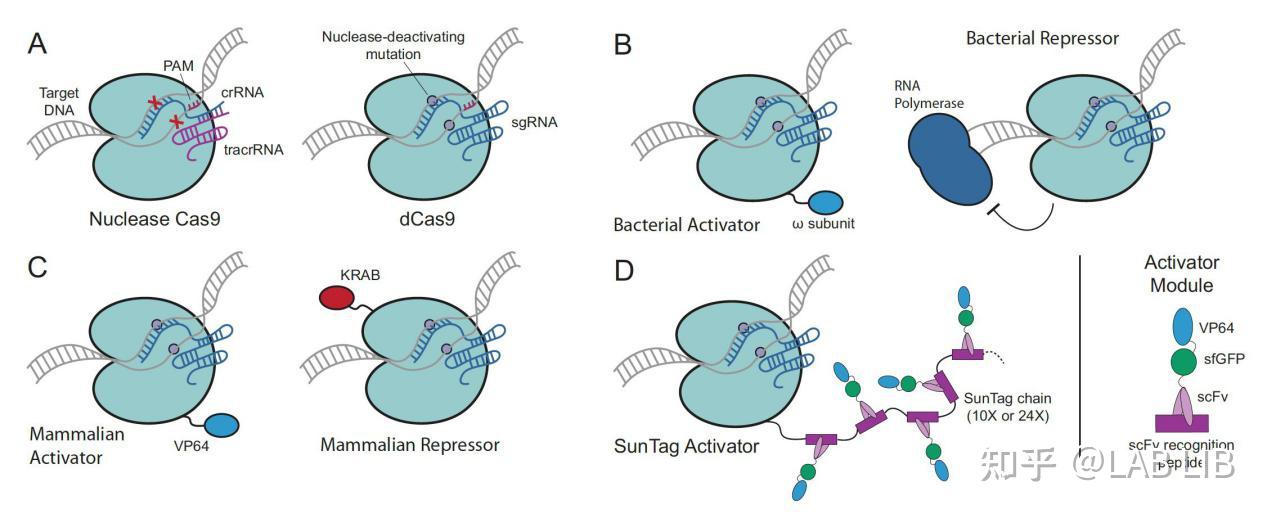
图A呈现了正常的Cas9蛋白和dCas9蛋白.
图B的第一幅图将 w subunit与dCas9 蛋白融合, 这样Cas9蛋白可以定位到特定的位置, w subunit可以召集转录因子, 由此激发转录过程, 第二幅图, dcas9可以结合到RNA聚合酶的下游, 阻挡聚合酶继续转录从而抑制转录.
图C中则同通过融合VP64去激活哺乳动物细胞的基因转录和通过融合KRAB去抑制转录.
图D则更为先进, 相比于图C中只融合一个VP64激活因子来说, 这里的方法是融合一个多肽(scFV peptide), 其中包含了VP64, 而多肽之间是可以结合的, 这样就大大的提升了激活因子VP64的召集率, 一个dCas9蛋白最多可以召集24个VP64, 大大提升转录效率.
7.CPISPR生物传感系统
原文地址:https://zhuanlan.zhihu.com/p/570660812 |
|
 /3
/3 