登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
引言
许多不同类型的癌症都与已知的基因异常有关,而癌症的激发往往是细胞中的基因突变累积到一定程度造成的。这样的“故障”有时来自遗传,有时是由烟草、甲醛等外部因素,但无论起源如何,了解癌细胞的基因组成有助于癌症诊断,并最终为患者提供更合适的治疗方式和更好的护理手段。荧光原位杂交(Fluorescence in situ Hybridization, FISH)通过可视化遗传物质的特定片段来帮助构建癌症诊断的全貌。
FISH的工作原理及在癌症诊断中的应用
原位杂交技术(ISH)最初由Joseph Gall和Mary Lou Pardue在1969年开发,使用放射性探针确定杂交核酸的染色体位置。不久之后,荧光探针基于其更高的安全性、稳定性和易于检测性,迅速替代了放射性探针,并从上世纪80年代开始进入高速发展阶段。
FISH主要应用DNA的碱基互补配对原理,使变性成单链的DNA探针与细胞中变性后的同源序列特异性退火(杂交),在荧光显微镜暗场下观察并记录结果[1]。
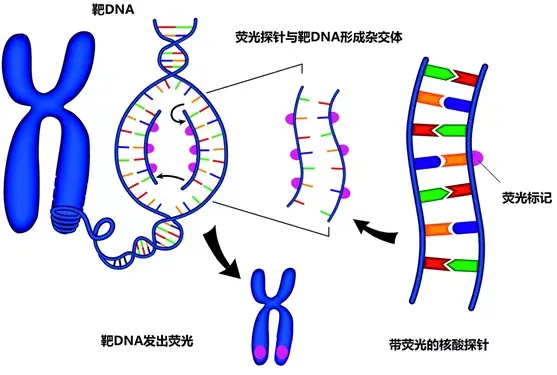
使用带有荧光标记的人工DNA片段,即探针,与互补的靶DNA杂交,使染色体的对应区域发出荧光。
在临床,FISH目前最常用于乳腺癌、淋巴瘤、肉瘤、多发性骨髓瘤、骨髓增生异常综合征(MDS)和部分白血病的诊断。
以慢性粒细胞白血病(CML)中常见的费城染色体为例,其是9号染色体和22号染色体长臂异位,使原癌基因ABL和BCR重新组合成融合基因的结果。当我们分别用红色和绿色标记ABL和BCR基因,在荧光显微镜下观察正常染色体时,应该只能看到这两种颜色;但当基因融合发生时,我们将可以观测到两种颜色融合而成的黄色[2](下图)。
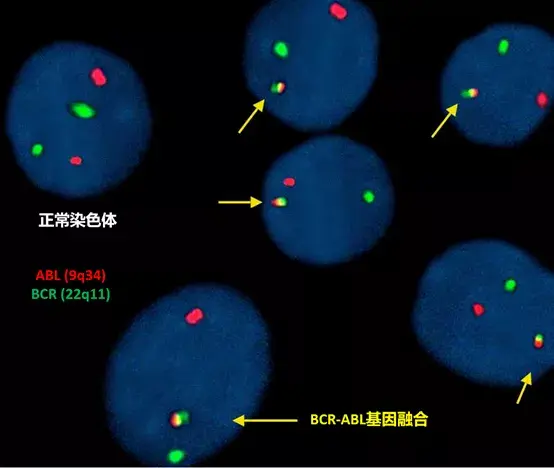
Asif et al. 2016
除了以费城染色体为例的染色体易位,FISH还可以显示异常复制/扩增、倒位和删除。复制/扩增指染色体、部分染色体或基因的额外拷贝;倒位指染色体的一部分断裂并重新插入,但顺序相反;删除指染色体或部分染色体的缺失。
FISH结果在癌症的诊断治疗中发挥着什么作用?
用于诊断
随着FISH的普及,许多癌症的基因/染色体错误已被追踪,让我们定义了特定的癌症诊断。例如,一种称为急性早幼粒细胞白血病的急性髓系白血病亚型是由15号和17号染色体之间的易位定义的。
用于预后
癌细胞的生长速度及其扩散能力部分取决于其遗传信息。利用FISH的结果,我们可以更好地预测肿瘤的行为方式。例如,两名同样确诊为骨髓增生异常综合征的患者,一位显示7号染色体的缺失,通常病程进展很快;另一位显示20号染色体的缺失,则通常疾病进程更慢。
预测对治疗的反应
使用FISH,我们可以识别与肿瘤对治疗反应程度相关的遗传变化,从而预测肿瘤是否对某种药物敏感或耐药。例如,17号染色体的额外拷贝突变又被称作HER2,这可能反应携带这种突变的肿瘤更容易受药物曲妥珠单抗的影响。
用于监测
如果治疗成功,患者的染色体应该恢复正常。但如果治疗后在另一轮FISH检测中发现异常,则意味着患者有残留突变点,癌症复发的风险很高。
FISH的敏感性和特异性
如今较成熟的FISH诊断主要包括肺癌中的ALK和ROS1、乳腺癌的HER2、卵巢癌的CCNE1、尤文肉瘤的EWSR1、滑膜肉瘤的SS18等等。其中非小细胞肺癌中的ALK重排是FISH检测最成熟的领域之一,敏感性和特异性可达100%[3]。但近期有多篇综述和报告指出,由于样本类型的限制和各类技术各自的优势和局限性,FISH应与IHC、NGS等手段共用于临床诊断(下图)。
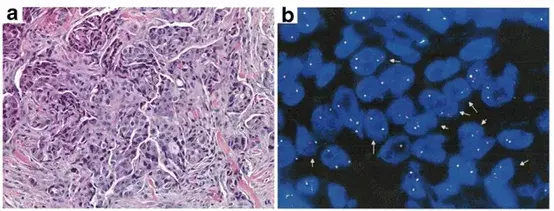
同一病例的组织活检和ALK-FISH检测结果。前者确定患者为转移性中分化肺癌,FISH进一步确认该患者的“典型ALK重排”。Niu et al. 2017
FISH结果的准确性部分取决于执行人员的操作规范,因为FISH的结果是通过对每个细胞中探针的杂交信号进行计数来获得的。尽管计数信号大多仍以手动方式执行,但也有可用的自动计数系统。常规的计数程序包括确定被分析细胞数量、设置对照载玻片、设置异常结果截止值、编程算法识别细胞和荧光信号等。目前美国使用的FISH对淋巴和实体瘤获得性染色体异常进行染色体研究的标准和指南,由代表美国医学遗传学和基因组学学院(AMCG)的临床实验室制定。需要注意的是,第一次计数评估的结果应由第二位诊断人员进行验证,以此确保可靠性,并降低出错风险。此外,原位杂交过程和先进软件的自动化可以显著提高工作质量。
另一方面,FISH的敏感性和特异性高度取决于设计的探针类型。在国内,由于成本和硬件等限制,多用标记单一融合基因的探针。即使在临床实验环境较好的美国,多色FISH多数也被用于基础实验,仅有少数被应用于癌症诊断。所以,面对不同的重排类型,FISH检测可能会给出假阴性或假阳性的结果。
临床FISH检测面临的其他挑战包括难以识别特定的易位类型,如常见的EML4-ALK融合,由于是染色体倒位,较普通染色体间易位而言更难观察到[4]。在样品制备中的某些过程,比如骨活检样品的脱钙可能会干扰检测的退火步骤,造成假阴性结果。
了解更多请关注公众号:医讯药闻(微信号:yixunyaowen)
结语
FISH给我们提供的最美妙的功能是让在原位直接可视化单个细胞内部成为可能。在过去40年中,通过应用一系列基于FISH的技术,肿瘤材料的细胞遗传学分析得到了极大的加强。在临床应用中,FISH检测主要受限于对昂贵的设备需求与复杂的技术操作和数据解释,但对部分研究成熟的癌种,如非小细胞肺癌,FISH检测依然是无可置疑的金标准。
参考
- ^Shakoori A. R. (2017). Fluorescence In Situ Hybridization (FISH) and Its Applications. Chromosome Structure and Aberrations, 343–367.
- ^Asif, Jamal, M. S., Khan, A. R., Naseer, M. I., Hussain, A., Choudhry, H., Malik, A., Khan, S. A., Mahmoud, M. M., Ali, A., Iram, S., Kamran, K., Iqbal, A., Abduljaleel, Z., Pushparaj, P. N., & Rasool, M. (2016). A Novel Four-Way Complex Variant Translocation Involving Chromosome 46,XY,t(4;9;19;22)(q25:q34;p13.3;q11.2) in a Chronic Myeloid Leukemia Patient. Frontiers in Oncology, 6, 124–.
- ^Demidova, I., Barinov, A., Savelov, N., Gagarin, I., Grinevitch, V., Stroiakovaski, D., Popov, M., Laktionov, K., Gutorov, S., Smolin, A., Olshanskaya, Y., & Obukhova, T. (2014). Immunohistochemistry, fluorescence in situ hybridization, and reverse transcription-polymerase chain reaction for the detection of anaplastic lymphoma kinase gene rearrangements in patients with non-small cell lung cancer: potential advantages and methodologic pitfalls. Archives of pathology & laboratory medicine, 138(6), 794–802.
- ^Niu, Chuang, J. C., Berry, G. J., & Wakelee, H. A. (2017). Anaplastic Lymphoma Kinase Testing: IHC vs. FISH vs. NGS. Current Treatment Options in Oncology, 18(12), 1–18.
原文地址:https://zhuanlan.zhihu.com/p/438107774 |
 /3
/3 