金桔
金币
威望
贡献
回帖0
精华
在线时间 小时
|
登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
本帖最后由 mce 于 2024-4-9 10:34 编辑
“肝”不动了?肝脏疾病的发展竟然这么多学问?一文讲清关于肝脏疾病的造模方法。

人类肝癌的发生通常继发于慢性肝病 (Chronic liver disease, CLD),如酒精性脂肪性肝病 (Alcohol-related fatty liver disease, AFLD) 和非酒精性脂肪性肝病 (Nonalcoholic fatty liver disease,NAFLD)。AFLD 和 NAFLD 二者有相似的病理谱,慢性病理性损伤可导至过度纤维化、肝硬化并最终导至肝细胞癌 (Hepatocellular carcinoma, HCC)[1]。
图 1. 肝脏疾病的发展阶段[1]。

▐ 酒精性肝病模型
酒精对酒精性肝病 (ALD) 的发生和进展的影响与饮酒的量和持续时间成正比[2]。研究慢性酒精滥用最常用的动物模型是 Lieber-DeCarli 液体饮食模型、灌胃乙醇模型和饮用水酒精模型[2]。
Lieber-DeCarli 液体饮食法是将酒精加入完全液体饮食中来喂养,研究者可以根据需求进行营养元素的调整。动物除了含有乙醇的液体饲料外没有任何食物或饮料。这种造模方法会导至早期肝损伤,不会发展到 ALD 的最严重阶段。
灌胃乙醇输注模型是将酒精直接注射到胃中。该模型可以维持高血液酒精浓度,并产生显著的肝损伤。然而,这种造模方法较昂贵,对实验操作人员的技能有严格要求。
图 2. 长期植入胃导管的小鼠[3]。
饮用水中的酒精模型最接近地模拟了依赖酒精的人类饮酒模式,操作简单,目前被广泛应用,并且可以与其他辅助因子 (如铁、高脂饮食、维生素补充、LPS 注射) 诱导其他进行性肝病[4]。
图 2. 慢性酒精给药诱导 12 月龄小鼠肝脂肪变性[2]。
酒精处理小鼠或对照小鼠的肝脏,以及酒精处理小鼠或对照小鼠的 HE 染色和油红 0 染色肝脏切片。
▐ NAFLD 模型
NAFLD,非酒精性脂肪性肝病,是指没有酒精滥用史的患者肝脏中脂肪堆积过多的一种疾病。NAFLD 分为单纯性脂肪变性和非酒精性脂肪性肝炎 (Nonalcoholic steatohepatitis,NASH)。目前,基因模型、饮食模型、化学模型等已被广泛用于 NAFLD 的临床前研究中[5][6]。
图 2. 临床前研究的 NAFLD 模型[7]。
在 NASH 中,不仅存在脂肪变性还存在小叶内炎症和肝细胞球囊化,常伴有进行性纤维化。长期存在的 NASH 可能发展为肝硬化,肝细胞癌。饮食模型是 NASH 研究中常用模型。C57BL/6 小鼠、Wistar 大鼠和 Sprague Dawley 大鼠由于其固有的肥胖、DM2 和 NAFLD 倾向而作为 NAFLD/NASH 造模的 模式动物。发病时间以及伴随代谢特征的程度取决于物种、品系、性别、肠道微生物群的组成以及所采用的饮食干预[5]。 模式动物。发病时间以及伴随代谢特征的程度取决于物种、品系、性别、肠道微生物群的组成以及所采用的饮食干预[5]。
表 1. 常用的饮食模型[5][8]。 ▐ 肝纤维化及晚期肝病模型
肝纤维化的主要原因包括酗酒、慢性肝炎病毒感染和非酒精性脂肪性肝炎,可发展为肝硬化甚至肝细胞癌 (HCC)。利用化学手段进行肝纤维化及晚期肝病诱导是目前临床前研究的常用模型。化学药物进入肝细胞产生毒性代谢物,引起肝持续损伤,诱导肝脏疾病的发生。乙醇、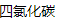 (CCl4)、硫代乙酰胺 (TAA)、 (CCl4)、硫代乙酰胺 (TAA)、 (DMN)、二乙基亚硝胺 (DEN) 等肝脏毒素是常用的化学诱导剂[8]。在大多数情况下,腹腔注射这些化学物质会在相对短期内引发肝纤维化;口服或者吸入会需要更长的发展周期。 (DMN)、二乙基亚硝胺 (DEN) 等肝脏毒素是常用的化学诱导剂[8]。在大多数情况下,腹腔注射这些化学物质会在相对短期内引发肝纤维化;口服或者吸入会需要更长的发展周期。
CCl4 是啮齿类动物肝纤维化和肝硬化研究中应用最广泛的肝毒素,其造成的损伤类似于人类肝纤维化的重要特性,包括炎症、再生和纤维形成,常用于研究急性肝损伤、晚期肝纤维化及纤维化逆转。CCl4 模型适用于大鼠和小鼠,但小鼠由于CCl4 代谢率更高成为造模的 。小鼠对 CCl4 诱导的肝纤维化的易感性是菌株依赖性的,与 C57BL/6 和 DBA/2 相比,BALB/c 小鼠在 CCl4 给药后表现出更多的肝纤维化病理特征[9]。CCl4 诱导的肝纤维化模型具有很高的可重复性,因此是药物筛选的 。小鼠对 CCl4 诱导的肝纤维化的易感性是菌株依赖性的,与 C57BL/6 和 DBA/2 相比,BALB/c 小鼠在 CCl4 给药后表现出更多的肝纤维化病理特征[9]。CCl4 诱导的肝纤维化模型具有很高的可重复性,因此是药物筛选的 候选者。 候选者。
表 2. 常见化学诱导肝脏疾病模型。
DEN 是一种基因毒性致癌物,被广泛用于诱导啮齿动物 HCC。单次 DEN 的 HCC 形成时间不仅与剂量有关,还与年龄、性别和遗传背景等因素有关。研究表明,雌性小鼠对 DEN 驱动的肝癌发生具有很大的抵抗力[18]。当小鼠长期反复暴露于 DEN 时,100% 的雄性小鼠而只有 30% 的雌性小鼠发生肝脏肿瘤。与成年小鼠相比,幼龄小鼠的 HCC 诱导率更高。对于不能通过单一 DEN 诱导 HCC 的成年小鼠,需要使用其他肿瘤促进剂,如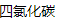 (CCl4)、 (CCl4)、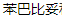 和高脂肪饮食喂养[19]。此外,DEN 与 CCl4 联合诱导可改善传统化学诱导耗时较长的缺点,而且更好地模拟了人类肝癌的发展过程。 和高脂肪饮食喂养[19]。此外,DEN 与 CCl4 联合诱导可改善传统化学诱导耗时较长的缺点,而且更好地模拟了人类肝癌的发展过程。

当然,除了以上不同发展阶段肝脏疾病的常见造模方法,手术、转基因、免疫、饮食与化学手段联用等手段也可用于肝脏疾病造模[8][9]。例如,胆总管结扎术 (BDL) 可引起胆汁淤积性损伤和门静脉周围胆道纤维化;CCl4 可以增强 HFD 对 NASH 和纤维化的发展进程;4 ~ 6 月龄 Mdr2 缺陷小鼠可发生 HCC。大家可以结合参考文献,根据自己的实验目的选择合适的造模方法喔~

Carbon tetrachloride 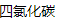
通过交感神经通路诱导急性肝损伤。引起肝纤维化和肝毒性,广泛用于肝脏疾病造模。 | Thioacetamide,TAA
一种间接的肝毒素,可引起实质细胞坏死。 | Dimethylnitrosamine,DMN
一种强效的肝毒素、致癌剂和诱变剂。 | N-Nitrosodiethylamine,DEN
一种有效的致癌物质二烷基硝胺。 | Aflatoxin B1,黄曲霉毒素
一类 1A 级致癌物质,是 Aspergillus flavus 和 A. parasiticus 的次生代谢产物。 | | |
MCE的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献:
[1] Carlessi R, et al. Mouse Models of Hepatocellular Carcinoma. In: Tirnitz-Parker JEE, editor. Hepatocellular Carcinoma [Internet]. Brisbane (AU): Codon Publications; 2019 Oct 24. Chapter 4.
[2] Tan P, et al. Establishment of an alcoholic fatty liver disease model in mice. Am J Drug Alcohol Abuse. 2017 Jan;43(1):61-68.
[3] Tsukamoto H, et al. Insights into the pathogenesis of alcoholic liver necrosis and fibrosis: status report. Hepatology. 1990 Sep;12(3 Pt 1):599-608.
[4] Brandon-Warner E, et al. Rodent models of alcoholic liver disease: of mice and men. Alcohol. 2012;46(8):715-725.
[5] Van Herck MA, et al. Animal Models of Nonalcoholic Fatty Liver Disease-A Starter's Guide. Nutrients. 2017;9(10):1072.
[6] Takahashi Y, et al. Animal models of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis. World J Gastroenterol. 2012;18(19):2300-2308.
[7] Oligschlaeger Y, et al. NAFLD Preclinical Models: More than a Handful, Less of a Concern? Biomedicines. 2020 Feb 8;8(2):28.
[8] Wu S,et al. An update on animal models of liver fibrosis. Front Med (Lausanne). 2023 Mar 23;10:1160053.
[9] Yanguas SC, et al. Experimental models of liver fibrosis. Arch Toxicol. 2016 May;90(5):1025-1048.
[10] Zhang L, et al. Mangiferin relieves CCl4-induced liver fibrosis in mice. Sci Rep. 2023 Mar 13;13(1):4172.
[11] Lin CY, et al. Establishment of a Rat Model of Alcoholic Liver Fibrosis with Simulated Human Drinking Patterns and Low-Dose Chemical Stimulation. Biomolecules. 2023 Aug 24;13(9):1293.
[12] Farouk K. et al. Therapeutic Effect of Dunaliella salina Microalgae on Thioacetamide- (TAA-) Induced Hepatic Liver Fibrosis in Rats: Role of TGF-β and MMP9. BioMed Research International. 2019
[13] Chandrashekar DV, et al. Effects of chronic cirrhosis induced by intraperitoneal thioacetamide injection on the protein content and Michaelis-Menten kinetics of cytochrome P450 enzymes in the rat liver microsomes. Basic Clin Pharmacol Toxicol. 2023 Feb;132(2):197-210.
[14] Fukawa A, et al. Bovine milk-derived α-lactalbumin prevents hepatic fibrosis induced by dimethylnitrosamine via nitric oxide pathway in rats. Biosci Biotechnol Biochem. 2017 Oct;81(10):1941-1947.
[15] Jézéquel AM, et al. Dimethylnitrosamine-induced cirrhosis. Evidence for an immunological mechanism. J Hepatol. 1989 Jan;8(1):42-52.
[16] Sladky VC, et al. PIDDosome-induced p53-dependent ploidy restriction facilitates hepatocarcinogenesis. EMBO Rep. 2020 Dec 3;21(12):e50893.
[17] Tripathy A, et al. The molecular connection of histopathological heterogeneity in hepatocellular carcinoma: A role of Wnt and Hedgehog signaling pathways. PLoS One. 2018 Dec 4;13(12):e0208194.
[18] Tolba R, et al. Diethylnitrosamine (DEN)-induced carcinogenic liver injury in mice. Lab Anim. 2015 Apr;49(1 Suppl):59-69.
[19] Zheng HC, et al. An overview of mouse models of hepatocellular carcinoma. Infect Agent Cancer. 2023 Sep 5;18(1):49.
|
|
 /3
/3 