登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
2022年10月31日,由University of Bristol领导的一项研究发表于《Advanced Science》上,题目:Macrophage Reprogramming with Anti-miR223-Loaded Artificial Protocells Enhances In Vivo Cancer Therapeutic Potential(链接:https://doi.org/10.1002/advs.202202717)。  University of Bristol生物化学学院细胞生物学教授、该研究的主要作者之一保罗·马丁解释了当我们的免疫系统接触到癌细胞时会发生什么:“我们的免疫细胞有一种监视能力,使它们能够检测到身体任何组织部位出现的癌前细胞。然而,当免疫细胞遇到癌细胞时,它们通常会被癌细胞颠覆,反而倾向于滋养癌细胞,鼓励癌症发展。我们想测试是否有可能重新编程我们的免疫系统,杀死这些细胞,而不是培养它们。”
科学家们利用重编程的微型人造胶囊激发局部炎症,促使免疫细胞(噬性粒细胞和巨噬细胞)高效吞噬癌细胞,使它们更有效地杀伤和减缓黑色素瘤细胞的生长。科学家们首先在斑马鱼幼体中测试了概念证明,由于它们的半透明性,研究人员可以观察炎症免疫细胞与癌细胞之间的相互作用。 装载抗miR223分子的原细胞结合并干扰炎症免疫细胞中的信号传导机制,并通过有效延长其促炎状态发挥作用,被证明可以改变免疫细胞-癌细胞的相互作用,减缓癌细胞的生长,并增加幼虫中肿瘤细胞的死亡。为了弄清这种方法是否可以放大,该实验在患有尾鳍黑素瘤的成年鱼中重复,表明这种方法显著抑制了黑素瘤细胞的生长(见图1)。 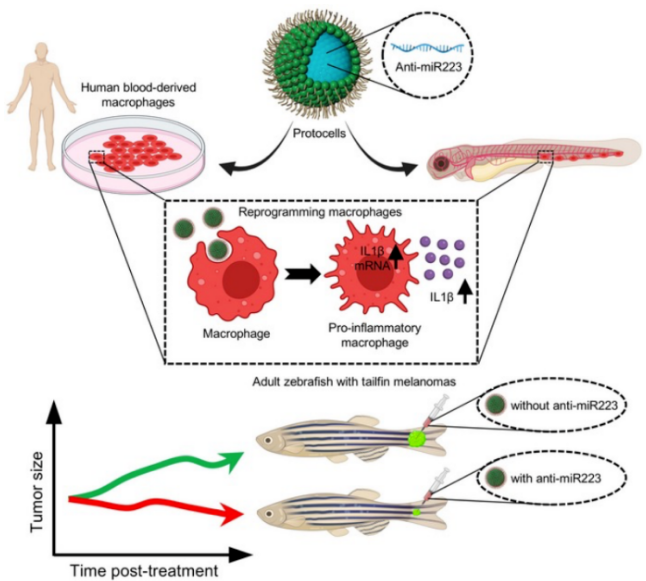 图1:抗 microRNA-223修饰的微型人工原代细胞,重编程幼虫和成年斑马鱼中的癌症相关的巨噬细胞,导至它们更具促炎性,从而减少黑色素瘤的体积 为了充分研究使用抗miR-223修饰的人造原始细胞(PC)在人体中递送的可行性,该实验再次使用来自托耶实验室的初级人类免疫细胞进行体外试验,该实验的结果表明,在抗 miR-223 原始细胞(PC)处理的巨噬细胞中,促炎细胞因子IL-1β的mRNA水平增加了近50%。这些人体巨噬细胞的其它促炎细胞因子均显著上调,包括白细胞介素6(IL-6)和白细胞介素12B (IL-12B) 。表明抗miR-223修饰的人造原代细胞能够有效地传递和重新编程人类免疫细胞,使其进入更持久的促炎状态来抵抗癌症(见图2)。
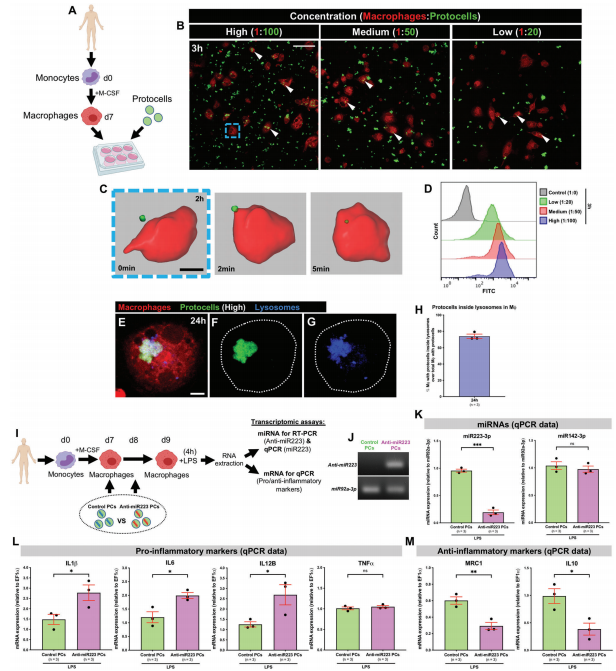 图2 体外实验证实了人巨噬细胞吞噬抗miR-223细胞,增强了促炎标志物的表达 University of Bristol的斯蒂芬·曼教授补充说:“我们的研究结果突出了利用宿主免疫根除癌症的治疗效益,并证明了miR-223修饰的人造原代细胞能够有效地传递和重新编程人类免疫细胞的可行性。”虽然我们在斑马鱼上的实验是早期的临床前研究,但我们的结果表明,至少在体外,人类免疫细胞也可能发生同样的情况,并可以类似地重新编程来抑制癌症生长。”由于miR-223在调节白细胞的促炎症表型方面具有确定的作用,因此它可能是一个治疗靶点,并且不仅局限于黑色素瘤,在其他实体肿瘤方面具有广谱性,为癌症免疫疗法的发展提供了一个有前途的新靶点。
|  /3
/3 