登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
目前,全球医疗决策中约有三分之二是依据诊断做出,其中体外诊断(in vitrodiagnostics,IVD)已是预防诊断和治疗疾病过程中的重要环节。体外诊断从人体样本中获取临床检测信息,达到诊断的目的。体外诊断市场可以细分为体外诊断试剂和体外诊断仪器两个部分。就国内体外诊断市场而言,体外诊断试剂占据大部分的体外诊断市场。 国家食品药品监督管理总局(CFDA)2014公布的《 体外诊断试剂注册管理办法》中指出,体外诊断试剂是指按医疗器械管理的体外诊断试剂,包括可单独使用或与仪器、器具、设备或系统组合使用,在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂(盒)、校准品、质控品等产品。CFDA2017年通过的《 体外诊断试剂注册管理办法修正案》,表明体外诊断试剂全链条动态质量管理是提升产业格局、优化产品结构的监管方向。 1 体外诊断试剂领域的技术研发1.1 发展历程体外诊断试剂行业在我国开展较晚,20世纪70年代才刚刚拉开帷幕[1]。1970年初, 我国小规模引进西方国家的技术设备,诊断试剂产业的雏形初现;1980年,开始大量引入海外先进技术,出现一批体外诊断试剂的生产企业,诸如生化类诊断试剂的北京中生、深圳迈瑞等生产企业,免疫类诊断试剂的上海科华、郑州安图等生产企业;20世纪90年代初期,生化类诊断试剂已有100多家的生产企业,免疫类诊断试剂的生产企业约300家,但大多数缺少合法资质,此时诊断试剂行业竞争白热化;90年代后期,CFDA着手对血源筛查类、免疫类诊断试剂开展市场清查,取缔违规不合格生产厂家;2010年之前,我国体外诊断试剂生产企业集中于较低端的生化与免疫诊断市场,缺乏创新性;2010年之后,体外诊断技术得到快速发展,尤其是分子生物学技术在临床检验领域应用带来的新一轮医疗革命。 近些年,我国先后出台了一系列规范性法规,包括《体外诊断试剂临床试验技术指导原则》以及《体外诊断试剂质量评估和综合治理方案》,推进了体外诊断领域的基础研究,研究成果呈直线式增长,并有望在总量上赶超美国。
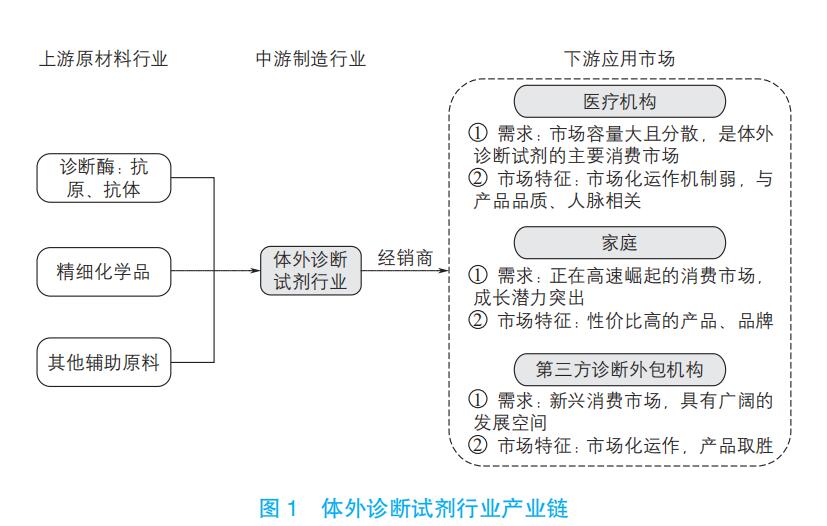 1.2 行业产业链
1.2 行业产业链 体外诊断试剂行业产业链是由上游原材料、中游体外诊断试剂、下游服务和需求共同组成(图1)。产业链的上游为原材料生产,当前我国诊断试剂领先企业均已加大原料研发力度。产业链的中游为试剂生产,且产业链所涉及的企业主要为位于中游的试剂厂商。目前我国体外诊断试剂中高端市场基本为国外大牌所垄断,国内生产企业数量众多但市场相对分散,产品同质化较为严重,逐渐进入到价格战阶段。此时,中游的体外诊断试剂厂商的渠道能力是竞争重点。产业链的下游业务拓展一般是通过经销商或由厂商直接销往医院、体检中心、临检中心、血站、防疫站及血液制品厂家等终端用户。目前各级医院是体外诊断产品最主要的终端用户。 从整个产业链来看,我国上市公司多集中在上游试剂原料提供、中游诊断产品生产和下游数据分析服务提供,部分核心原材料需要进口。我国新材料与上游试剂原料行业在近几年已经逐渐做大做强,根据美国分子诊断行业发展历程来看,我国体外诊断试剂行业已经进入到了行业整合提速阶段。 1.3 技术发展路径按检测方法或原理划分,体外诊断试剂包括生化诊断、免疫诊断、分子诊断、即时诊断(POCT)、凝血类诊断和血液学等试剂。我国诊断试剂主要的四大类产品信息详见表1。
 从
从20世纪初第一台生化分析仪诞生,到免疫分析和分子诊断的兴起,体外诊断行业得到快速发展。体外诊断试剂先后经历了生化诊断、免疫诊断、分子诊断与POCT4个发展阶段。其中,前3个阶段于实验室完成,最后1个阶段可在家中进行。另外,国内分子试剂占体外诊断试剂比约为5%,而世界范围内此比例高达11%,因此,代表了未来研发方向的分子诊断和POCT等细分领域在我国还处于早期发展阶段。 1.3.1 生化诊断 生化诊断(clinicalbiochemistry)产品在我国发展较早,为医院常规诊断检测项目。其检测系统大部分是开放式。国产试剂历经以往的发展,质优价廉,品种丰富。试剂基本完成进口替代,国产品牌市场占有率超过60%,国内生产性企业200多家。 1.3.2 免疫诊断 免疫诊断(immunodiagnostics)运用免疫学理论、技术与方法诊断各种疾病和测定免疫状态。免疫诊断试剂在诊断试剂盒中品种最多,主要用于肝炎检测、性病检测、肿瘤检测、孕检等。 免疫诊断技术包括化学发光免疫分析技术(CLIA)、时间分辨荧光免疫分析技术(TRFIA)、电化学发光免疫分析(ECLA)和流式荧光发光法等(表2)。区别在于标记抗原、抗体,最终定量检测反应信号所涉及的方法不同。
 化学发光试剂在短短
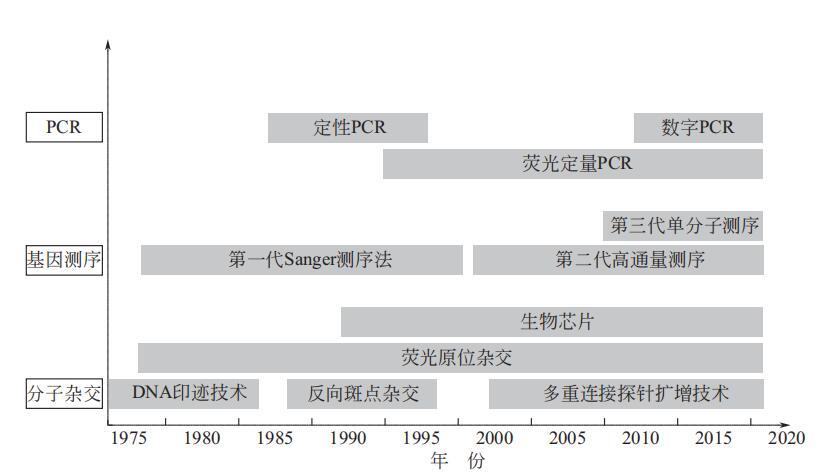
化学发光试剂在短短20年内快速发展,市面上已有4代试剂。第一代试剂主要以异鲁米诺为发光标记物,采用CLIA方法,代 表 有 索 林 的Liaison ;第二代试剂采用竞争性抑制酶免疫测 定(CIEIA),代表为强生的Ortho VitrosECi & Vitros3600,采用辣根酶标记鲁米诺为发光物;市面上主流的试剂主要为第三代试剂,包括采用CLIA用吖啶酯为标记物的试剂,代表为雅培的Architecti系列和西门子的Centaur系列,还有以碱性磷酸酶标记AMPPD为发光物的试剂,如 Beckman 的 BCI ACCESS2& DxI800、西门子的Immulite系列和奥林巴斯的AU3000i;电化学发光试剂,罗氏宣称其为第四代化学发光试剂,于1996年推出,其专利已经在2016年过期,国内已有企业在电化学发光领域进行了紧密布局。 1.3.3 分子诊断 分子诊断(moleculardiagnostics,MDx)是一门运用分子生物学方法、技术,以获得人体生物大分子及其体系的存在结构或表达调控的变化,为疾病的防治、预测、诊断、治疗和预后判断提供信息和决策依据的新兴学科。分子诊断检测的是遗传物质的状态变化,遗传物质的编码决定表达成什么样的蛋白,表达成什么样的蛋白又决定了具体的个体是怎么样的表型,具体的表型又可能影响面对不同的病原体时的症状、进展等。 人体遗传物质(核酸)的状态和变化情况检测是分子诊断的核心。核酸检测的应用可大致分为3类:临床感染性疾病病原体核酸检测、血液筛查核酸检测、人体基因核酸检测。分子诊断的主要技术有核酸分子杂交(FISH)PCR和生物芯片技术。 分子诊断的发展(图2)可分为3个阶段:1978年简悦威等应用液相DNA分子杂交成功地进行了镰形细胞贫血症的基因诊断,标志着分子诊断的诞生,此阶段分子诊断仅应用于检测遗传病以及产前诊断;由KaryMullis于1985年发明的PCR,经过不断发展,已成为分子生物学实验室的必备技术;1992年美国Affymetrix公司制造出第一张基因芯片标志着分子诊断进入生物芯片阶段,分子诊断应用进一步扩展。 1.3.4 即时诊断 即时诊断(point-of-caretesting,POCT),又称即时检测、即时检验、现场快速检测或者床边检测,通常不一定需要临床检验师来进行,在采样现场即时开展分析。POCT类产品具有使用方便、高效(出结果时间快,判读时间多在15min内)以及准确度高等特点,对于疾病预防、确定病因和预后效果、提高治疗有效性和减少医疗成本有重大意义,能满足各级各类医疗机构的临床检测需要。1995年美国临床实验室标准化委员会发布AST2—P文件,决定对POCT进行标准化管理。
POCT概念及技术在2004年首次引入我国,自2006年举办了多届POCT高峰论坛,我国POCT得到快速发展。2013年10月国家标准化管理委员会发布了《GB/T29790—2013即时检测质量和能力的要求》国家标准,将POCT命 名 为“ 及 时 检 测”,同时对POCT产品的质量保证能力提出了明确要求,该标准于2014年2 月1日正式实施。 POCT技 术 经 过 多 年 发 展,目前主要可分为干化学技术、 胶体金技术、传感器技术、生物芯片技术、未来有望代表技术主流的微流控技术及红外和远红外分光光度技术。技术的创新升级使得POCT的检验范围、精度等方面都得到了极大地发展。
|  /3
/3 