登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
本帖最后由 萝卜涨价了 于 2018-9-20 编辑
一、引言
多重PCR(multiplex polymerase chainreaction,MPCR)也称复合PCR,是在常规PCR基础上改进并发展起来的一种新型PCR扩增技术,即可在一个反应体系中加入两对以上引物,同时扩增出多个核酸片段,由Chambehian'于1988年首次提出,其反应原理、反应试剂和操作过程与常规PCR相同。多重PCR既有单个PCR的特异性和敏感性,又较之快捷和经济,在引物和PCR反应条件的设计方面表现出很大的灵活性。多重PCR还能提供内部对照,指示模板的相对数量和质量
当前临床上对感染性疾病的诊断主要依靠传统的微生物学方法以及血清学方法。经典的微生物学方法不仅繁琐、费时,并受诸多因素影响,容易漏检自然变异株,并且不能检测难培养或不可培养的致病微生物。血清学方法虽然发展较快,灵敏度也较高,但只能做追溯性诊断或提供间接的诊断依据,不能进行快速鉴定,并且有些细菌之间有交叉凝集现象。因此,这些传统的方法在鉴定方面日益显现出不足。过去10年间,分子生物学的发展为微生物的基因型检测和鉴定打开了一扇大门,这些发展开始影响到患者治疗的很多方面。DNA杂交研究首先应用于确证细菌间的关系,对核酸杂交化学的认识,使发展核酸探针技术成为可能。但类似于表型指标,在某些情况下,杂交的方法也可能受到微生物能被分离和生长的限制。核酸扩增技术又为临床微生物实验室的病原体的检测和鉴定铺设了道路。体外能够生长,一般来说不再是鉴定微生物所必须满足的条件。之所以能够如此,从根本上说是由于这些技术以特异核酸序列的酶学扩增代替了生物学扩增一培养生长。虽然任何PCR依赖的技术都不能区分活的和死的细胞,但由于具有其它方法不可替代的优势,PCR还是成为分子生物学中不可缺少的技术和方法。在过去20多年间,PCR技术和其它DNA信号与靶标扩增技术的发展已经使这些分子诊断技术成为临床上快速敏感诊断的关键性技术。一般PCR仅应用一对引物,通过PCR扩增产生一个核酸片段,主要用于单一致病因子等的鉴定。在诊断实验室中,PCR技术的应用主要受成本的限制,有时是因不能获得足够的待测样本体积。为了克服以上缺点,同时增加PCR技术的诊断能力,多重PCR的技术应运而生
自1988年Chamberlin等首次提出这一概念起,多重PCR技术已被广泛应用于核酸诊断的许多领域,包括基因敲除分析、突变和多态性分析、定量分析1以及RNA检测等,在感染性疾病领域,多重PCR技术已经显示出它的价值,成为识别病毒、细菌、真菌和寄生虫的有效方法。利用一次多重PCR反应,可同时检测、鉴别出多种病原体,在临床混合感染的鉴别诊断上具有其独特优势和很高的实用价值
二、原理
多重PCR基本原理与常规PCR相同,区别是在同一个反应体系中加入一对以上的引物,如果存在与各对引物互补的模板,则它们分别结合在模板相对应的部位,同时在同一反应体系中扩增出一条以上的目的DNA片段。多重PCR反应体系的组成和PCR循环的条件需要经过优化以确保同时扩增几个片段。理论上只要PCR扩增的条件合适,引物对的数量可以不限,但由于各种条件的限制,实际能够扩增的引物对数量是有限的。
PR结果的分析方法有以下几种,包括:琼脂糖凝胶电泳、聚丙烯酰胺凝胶电泳、核酸杂限制性酶切分析、核酸测序等,其中琼脂糖凝胶电泳是最简单、最快速的方法,但是与聚丙烯酰胺凝胶电泳相比分辨率比较低。限制性酶切分析需要将PCR产物回收酶切后再次电泳,耗时费力,难以推广应用。核酸测序是鉴定PCR产物最可靠的方法,但需要专门的测序仪器,并且需要花费的时间也比较长。如果要将鉴定感染性疾病病原的多重PR方法用于临床及现场流行病学调查,琼脂糖凝胶电泳是最佳的选择
三、材料
1.常规的PCR反应体系所需试剂
高压过的超纯水(高压的目的是使其中的DNase失活,以免降解模板DNA);
PCR缓冲液(选用与所用聚合酶对应的缓冲液)
4种dNTP混合物(每种dNTP的浓度为2.5mmol/L);
引物(引物合成后,用超纯水稀释为10mmol/L);
热稳定的DNA聚合酶(不同厂家、不同批次的酶可能会有差异);
DNA模板(尽量使用纯化后的核酸作为模板)。
2.实验仪器
PCR热循环仪、核酸电泳仪、凝胶成像设备、离心机等
四、方法
多重PCR实验设计远比单个PCR复杂,并不是简单地将多对特异性引物混合成一个反应体系,其反应体系的组成和反应条件需要根据实验结果反复调整,以适应同时扩增多个片段的需要。设计多重PCR反应体系时必须仔细考虑其扩增的区域、扩增片段的大小、引物的动力学及PCR循环条件的最优化等。
一)选择目标基因
由于多重PCR在同一个反应体系中需要加入多对引物,而模板直接影响扩增的结果分析,这就导至了扩增模板的选择至关重要。同时,扩增区域的选择必须符合分析的目的,如通常对于致病微生物,需要选择其保守序列,如16sRNA,或者毒力基因、毒力相关基因,以防止检测到非致病突变体而无法解释结果;对于需要分型的对象来说,需要选择它们之间有差异的保守序列进行扩增;对于高度同源的序列来说,可以用相同的引物进行扩增,但获得的阳性结果需要利用特异探针杂交或限制性酶切进行进一步确定;缺失分析选择扩增外显子;法医学鉴定个体差异选择扩增高度多态性标志;转基因检测则选择转入的动植物基因座;性别鉴定一般选择X或Y性染色体上特有的基因座
对于含有多个外显子的基因缺失分析来说,可选择缺失热点较广区域或缺失密集区域。相邻近的外显子可用跨越这两个外显子的引物进行扩增。
二)引物设计
引物设计的目的是找到一对合适的核苷酸序列,使其能有效地扩增模板DNA序列。因此,引物的优劣直接关系到PCR的特异性与灵敏度。要确定引物的位置,首先需要知道所选择的基因引物与模板结合部位的详细DNA序列信息。在多重PCR中,为了保证扩增效率,所有的引物对必须优化到相近的扩增条件。因此,多重PCR的引物设计除了要满足一般PCR引物设计的原则外,还要注意以下几个问题:各引物之间不能互补,尤其避免3的互补,以免形成二聚体,引物设计好以后进行PCR扩增,以检验引物之间是否配对形成二聚体;各引物与其它扩增片段和模板不能存在较大的互补性,扩增片段之间也不能有较大的同源性;对于引物的长
度、(G+C)含量、T值要求尽量一致;各引物扩增产物的片段大小要有一定的差别,以便于用电泳的方法进行区分。一般来说,产物片段越大,其长度的差别也应该越大。这就给多重PCR引物的设计带来了一定的难度
(三)核酸提取
核酸依赖的检测方法受目标核酸纯化的影响,核酸的纯化程度决定了核酸方法的应用。多重PCR的优势在于快速、系统,主要用于临床标本的检测,包括血液、组织、粪便等,同时多重PR对核酸模板的要求比较高,所以核酸的提取纯化显得尤为重要,直接与扩增结果
一般来说,通过煮沸裂解细菌制备模板可以满足普通PCR反应,但是用于多重PCR反应会存在很多问题。在条件允许的情况下,多重PCR需要以纯化的DNA为模板,可以确保多重PCR的顺利进行。
(四)单位点PCR(也叫单引物PCR)
在进行多重PCR之前,必须先对每对引物进行单位点PCR。确定每对引物进行单位点PCR时条件如表14-1所列
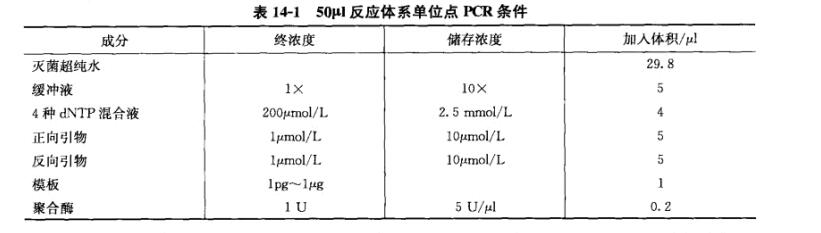
反应完成后比较扩增结果,确保在相同的循环条件下所有的引物都能扩增出对应的产物条带,以确保引物能够特异性扩增对应的目标序列
(五)多重PCR(引物等浓度混合)
反应体系中各对引物等浓度混合,体系中其它各成分的浓度不变,应用与单位点PCR相同的反应条件进行多位点同时扩增,根据扩增结果对多重PCR反应体系及反应条件进行调整,具体操作如下面所述
(六)优化多重PCR反应体系及反应条件
多重PCR的反应体系和反应条件基本与单位点PCR相同,但也不能一蹴而就,必须使多重PCR反应中每对引物对应的靶点都能获得足够的扩增量,并且扩增产物之间的产量应该基本影响多重PCR扩增效果的因素可以分为反应体系和反应条件两大类。其中反应体系包括引物、缓冲液、Taq DNA聚合酶、dNTP和MgCl2等,反应条件包括退火温度、延伸温度、延伸时间,循环数等
1.反应体系的优化
(1)引物浓度在多重PCR体系中,引物用量和扩增的目的片段长度有着正比内在关系,即扩增片段越长,所需引物就越多,片段越短所需引物相对就越少。同时,多重PCR扩增中每增加一重PCR扩增,引物间相互影响就加大,这就势必影响到扩增的效果。为了降低这种不利影响,选择适当的引物间浓度是确保多重PCR成功的一个关键因素。先对不同的引物进行单个PCR扩增,确定单个PCR各引物的最佳浓度,然后按照多重PCR的实验流程,进行两个或多个引物对的多重PCR预实验。多对引物会增加3末端引物互补的可能性,形成引物二聚体;也有可能发生一个扩增片段抑制另一个扩增片段的情况,这就导至了扩增结果并不是均一的。即使在优化了循环条件后,某些基因的扩增产物仍不明显。多重PCR反应体系优化经常可以遇到有个或两个靶位点的扩增产物很少甚至没有扩增产物,而其它引物的扩增效率都很好的情况。为解决这一问题,可以通过适当地调整引物的相对浓度加以解决,增加弱条带的引物量,减少亮条带的引物量。降低扩增效率高的引物对浓度比增加扩增效率低的引物浓度更有助于提高扩增效率低的产物的产量。多重PCR反应中各引物的浓度差异一般都凭经验获得。只有在调整引物浓度达不到要求时才考虑调整别的反应条件,例如改变反应体系中Mg2或KC的浓度等。
有些情况,例如扩增产物是序列相似但长度不同的扩增片段,最短的产物可能扩增得更好,尤其是有些扩增片段共用一个引物的时候。这种情况可以通过长扩增片段引物启动PCR几个循环后再加入扩增短片段的引物的方法避免,也可以通过降低扩增短片段的引物来解决。理论上讲,引物和基因靶序列的摩尔比至少为103:1,如此过量的引物才能确保模板DNA一且变性就与引物退火,而不是与其自身退火。一般引物量至少要10倍于模板量
(2)模板及模板浓度从血和新鲜组织中提取的DNA,浓度和质量均能满足多重PCR的要求。对于从菌体提取的DNA,为了减少样品对扩增结果的影响,裂解液中加入的菌量不能太多否则会因裂解不完全,菌体蛋白抑制DNA聚合酶的活性,造成假阴性结果
要达到稳定的结果,每个样品都应该测定浓度,实际工作中往往是抽样检测。所以,样本模板浓度往往参差不齐,导至每个样本扩增效率不完全均等,有时还会出现扩增失败的现象。此时要考虑模板的有效浓度,适当加以调整。几种不同来源的模板DNA的浓度为:哺乳动物基因组DNA100g/ml;酵母基因组DNA1g/ml;细菌基因组DNA0.1pg/ml;质粒DNA1~5ng/ml)dNTP和MgCl2的浓度dNTP和MgCl2是PCR反应体系中的重要成分,因此对dNTP和MgC1的浓度进行优化也是很必要的
PCR反应中一般用的dNTP和MgCl2的浓度分别为200m/L和1.5mmol/L。Mg2浓度在很大程度上影响扩增的特异性,Mg2+一般正比于dNTP的浓度,这个比值确定好后可以在调整其它反应条件时保持恒定。当保持dNTP的浓度不变,随着MgCl2浓度的升高,反应的特异性逐渐增强,但当增加到一定程度后,反应产物几乎为零。PCR反应中,dNTP和MgCl2的浓度应该平衡,这可能是因为dNTP能够结合镁离子,而TaqDNA聚合酶发挥活性需要游离的镁离子。另外,dNTP母液对于反复冻融十分敏感,反复冻融3~5次后,多重PCR反应常常不能很好进行,扩增产物几乎完全不可见,但dNTP的这种低稳定性在单一基因扩增中并不明显。
(4)PCR缓冲液(KCD的浓度如果多重PCR系统性地对扩增长的PCR产物有倾向性,最佳的选择是设计一系列多重PCR实验,固定Mg浓度(1.5mmo/L),依次递增KCl的浓度(1.0~2.0倍),对每对引物进行再优化。相反,如果倾向于优先扩增较短的产物,则应在保持KCl浓度不变的情况下逐步提高Mg2浓度(直至4.5mol/L)。如果所有产物的扩增效率都很低试着提高模板和热稳定DNA聚合酶的浓度。如果没有改善,则成倍增加所有引物的浓度并采用复性和延伸温度依次降低2的降落PCR。
PCR缓冲液的浓度从1×提高到2×可以明显提高多重PCR的效率,这种调节作用比调节DMSO、甘油或BSA更重要。通常产生长片段扩增产物的引物在低盐浓度下扩增结果更好,而生短片段扩增产物的引物在高盐浓度下扩增结果更好,高盐浓度会使长片段扩增产物难于变性解链
(5) TaqdNA聚合酶随着多重PCR体系中引物对数目的增多,dNTP和聚合酶的量也要相应增加。不同厂家的酶质量也有差异,需要做浓度梯度实验,寻找最佳的用酶量。使用过多的TagdnA聚合酶会导至不同基因扩增不平衡及背景的轻微增高,反应的特异性降低。可以在25反应体积中加入2U,然后根据扩增结果进行轻微的调整
(6)辅助剂(如DMSO、甘油、BSA)的应用在多重PCR反应体系中加入50~100ml/的DMSO或甘油能够提高多重扩增效率和敏感性,得到更多的扩增产物和减少非特异扩增。但是这些辅助剂可能会在另一方面干扰实验效果,因为它对各基因位点扩增效率的影响不同50ml/L的DMsO可能会提高某一位点的扩增效率,降低另一位点扩增产物的数量,而对某些位点则根本不产生影响;同理,DMSO可能抑制也可能是促进非特异性扩增。因而使用这些辅助剂的效果需要在每个具体的反应体系中加以验证。加入适量的BSA(如L.0g/L)能显著提高多重PCR扩增效率。有时候BSA效果要比DMSO和甘油好,但它的作用同样也需要实验的验证
有些研究人员建议使用浓度范围为5%~10%体积分数的DMSO和甘油来改善扩增的效率和特异性,但在多重反应中,DMSO的使用会出现矛盾的结果。因此,DMSO和甘油的调节对实验结果的影响要根据具体的实验来摸索。
2.反应条件的优化
由于在一个多重PCR反应体系中有多对引物,而且扩增的模板片段长度也不尽相同,所以各对引物的扩增效率和扩增速度也不相同。由于多重PCR反应总是遵循较小片段优先扩增的原则,各对引物所要求最佳PCR条件也不尽相同(设计多对引物进行多重PCR时,应使各引物所需PCR扩增条件尽可能一致),因此在选择多重PCR扩增条件(尤其是退火温度和时间)时应尽量选择有利于较大片段扩增的条件
(1)退火时间和温度在循环参数中,影响多重PCR扩增效率的主要因素是复性温度和延伸时间。复性温度的设置策略与单个PCR相似。先计算引物的熔解温度(Tm),在此基础上推算复性温度T。(T=T。-5)。然后用“逐步引人法”确定多重PCR的最佳T,即每增加一对引物,就根据扩增的结果调整复性温度,直至每一种被扩增的基因片段都获得满意的效果。延伸时间是影响扩增产量的重要因素。随着扩增的基因座数目的增加,延伸时间也应延长。在最佳的Mg2+和dNTP浓度范围内通过延长延伸时间来提高扩增产量,比单纯增加Mg2+和dNTP浓度更为有效。
退火时间对扩增效率的影响远远小于退火温度的影响,将退火温度降低4~6对于在多重PCR中扩增出同样的基因是必需的。多重反应中并发的其它基因的特异扩增会消除非特异扩增的影响,同样,扩增效率高的基因会使扩增效率低的基因的扩增产量降低
(2)延伸温度高的延伸温度会减少某些基因的扩增,即使用长的退火时间和延伸时间也可能无法消除这种影响。
(3)延伸时间在多重PCR中,由于同时扩增多个基因,酶和dNTP的缺乏就成为限制因素,就需要更多的时间来完成所有产物的合成。多重PCR中增加延伸时间,可以增加较长PCR产物的量。也有实验表明,当延伸时间延长时,所有基因的PCR产物量都增加了
4)PCR循环数PCR产物量增加最明显的是在25个循环附近。通常对于一个反应,2830个循环就足够了,增加至60个循环对产物量无明显影响
总之,多重PCR反应条件的设置是一个棘手的问题,也是多重PCR成功的保证。一般策略是首先进行单个PCR反应,分别设定各引物对应的条件;然后,依次增加引物对,不断调整反应条件直至最后保证所有的引物对都能在同一条件下扩增出目的条带。
五、常见问题的解决
针对多重PCR中的常见问题,可以通过改变影响PCR扩增效果的因素来解决
1.若所有产物条带都很弱
增加延伸时间;
降低延伸温度至62~68;
逐步降低退火温度;
调整 TaqDNA聚合酶的浓度;
同时应用以上4种策略。
2.若短片段产物条带较弱
缓冲液浓度从1×增加至1.5×或2×;
降低退火或延伸温度;
增加弱条带相对应的引物量;
同时应用以上3种策略。
3.若长片段产物条带较弱
增加延伸时间;
增加退火和/或延伸温度
增加弱条带相对应的引物浓度;
降低缓冲液浓度至0.7×~0.8×,同时保持MgCl2浓度1.5~2mmol/1L不变;
同时应用以上4种策略
4.若出现非特异产物
若非特异产物是长片段,增加缓冲液浓度至1.4×~2.0×;
若是短片段,降低缓冲液浓度至0.7×~0.9×;
逐渐增加退火温度
减少模板和聚合酶的用量;
增加Mg2至3mmol/L、6mmol/L、9mmol/L、12mmol/L-,同时保持dNTP浓度恒定在200umol/L:
同时应用以上5种策略
5.若以上方法都未见效,可以进行以下尝试
加入辅助剂BSA(0.1~0.8pg/p);
加入辅助剂DMsO或甘油(5%,体积分数);
重新比对引物,确保引物之间不存在相互作用;
六、应用
(一)多重PCR在遗传病诊断方面的应用
1.DMD和BMD的检测
Duchenne型肌营养不良症(Duchenne musculardystrophy,DMI)是一种很常见的人类遗传病,为X性染色体隐性遗传性肌肉变性疾病,50%的病例由基因缺失引起,大约每3500个男婴就有一个发病,1/3的病例由新的突变所致,肌营养不良基因长200kb,至少有70个外显子,被35个平均35kb的内含子所间隔1。目前尚无有效治疗的方法,因而高度准确的产前诊断和DMD阳性筛选是十分重要的。以往多用Southern分析技术来诊断,但由于该基因由多达70个外显子,至少需要7~9个cDNA克隆才能诊断,费用高、费时而难以常规开展。BMD是Becker型肌营养不良症(Becker musculardystrophy)的缩写。BMD亦为X性染色体隐形遗传性肌肉变性疾病。BMD的发病率为新生男婴的三万分之一。65%的BMD病例的原因是基因缺失。
Chamberlain等利用多重PCR技术对DMD进行了检测,设计了6对外显子引物。用1umol/L引物加10UTaq酶,延伸温度为?23min,25个循环。产物电泳后,如与正常对照的对应条带相比有缺失或移位,即为异常。随后该实验室又将引物增加至9对,使至少80%的DMD基因缺失得到确定,能直接诊断50%以上的病例。Hentemann等2设计了2对产物分别为140bp和73bp的引物,对42例病人检测后,发现7例基因缺失并经Southern杂交分析证实。Simard等报道用Chamberlain的引物对DMD进行扩增,并对DNA模板处理进行了改进,用lm羊膜液离心后的细胞经非离子去垢剂和蛋白酶K的PCR缓冲液裂解后直接PCR扩增,效果令人满意。由于DMD/BMD是等位基因,近来的文献多同时检测此两种疾病。Begs等用多重PCR同时检测肌营养不良基因的8个外显子和启动子,可使98%有基因缺失的DMD/BMD获得诊断。Covone等人用两种方法对照研究了127例DMD/BMID2一种方法是用与 DMDCDNA相关的9种cDNA探针与Hind消化的基因族DNA杂交,另一种方法是用9对DMD外显子的引物进行多重PCR检测,结果73例(57%)存在基因缺失,两组方法结果相近。我国华西医科大学的学者亦用Chamberlain的9对引物对17例DMD/MD病例进行了检测,结果8例(47%)发现基因缺失,证明了针对西方人的引物序列同样可以检测中国病例。
2.用于其它遗传病的检测
Pici等人鹆对囊性纤维化( cysticfibrosis,CF)基因突变进行了筛选研究,用4对外显子引物进行多重PCR扩增,然后用限制性内切酶消化PCR产物,再进行垂直聚丙烯酰胺凝胶电泳,检查15例发现有3例发生了基因突变。Pior等设计了8对引物同时检测DMD/BMD和CF,通过凝胶电泳筛选DMD/BMD缺失突变,并用等位基因特异的寡核苷酸杂交确定CF突变是否存在。实验表明,可以通过多重PCR的方法从血斑中获得足够的DNA进行分子分析,可用于新生儿的筛选。Pillers等人m用多重PCR和 Southern杂交方法研究了一位同时患AIED(Aland island eyedisease)、甘油激酶缺乏(GKD)和DMD的病例,发现在DXS67(1 deoxy-D-xylulose5- phosphatesynthase67)和DMD基因之间出现基因缺失。另外,还有用多重PCR方法筛查类固醇硫酯酶( steroidsulfatase,,srs)缺乏症和诊断β地中海贫血患者的报道。
脊髓性肌萎缩症(spinal muscularatrophy,SMA)是一种常染色体隐性遗传神经性肌肉疾病。SMA会造成位于脑底和脊髓的下级运动神经元分裂,从而使其无法发出肌肉进行正常活动所依赖的化学及电信号。SMA主要影响患者的近端肌,即最靠近人体躯干部的肌肉。控制胃、肠和膀胱等器官运动的非随意肌不会受到影响。各型都会对控制随意肌运动的叫作运动神经元的神经细胞产生影响。最近的基因研究发现,运动神经元的死亡也许是因为缺少一种或几种蛋白,或者是它们不能完全发挥其功能而导至的。Simard等应用多重实时反转录PCR方法(muli Xplex real-time reverse transcriptase-PCR)对存活运动神经元( survival motorneuron,SMN)的转录本进行定量,共检测了42个潜伏期SMA病人的血标本,每个病人取三个时间点,发现SMN的表达在每个病人的不同时间点上的转录是稳定的,SMN mRNA表达的实时定量检测可以作为SMA临床试验的生物标志以作为SMA临床试验的生物标志
甘露糖结合素(mannose-bindinglectin,MBu)是一种血清蛋白,能够触发补体激活,因此在先天性免疫中发挥重要作用。低水平的MBL会损伤病原微生物的调理作用,进而导至儿童的反复感染、免疫受损病人的严重感染以及自身免疫疾病。MHBL的编码基因位于人类10q11.2~q21染色体,包括四个外显子,血清中MBL水平受其启动子多态性和MB2基因第一个外显子突变的影响。目前应用的MBL基因分型方法主要有以下几种:PCR限制酶切分析、序列特异寡核苷酸探针杂交(sequence-specific oligonucleotide probes,SsOP)、放大受阻突变体系(amplification refractory mutation system,ARMs)、ARMS联合SSOP、异源双链分析(heteroduplex analysis)、实时PCR以及应用小沟结合DNA探针的5端核酸酶分析。Helena0等建立了种快速、高效的多重PCR方法对MBL2基因进行分型,并且将捷克人作为斯拉夫人的代表样本,应用此方法研究了MBI2的等位基因频率。共分析了359个不相关捷克人的MBL2基因,最终得出LYD单元型在斯拉夫人的祖先中比其它高加索人更常见,同时也证明了多重PCR是一种比传统PCR方法更快速、简便、省时省力的MBI2分型方法。
根据当前不育领域的研究,大约10%~15%的夫妇存在不育的问题,而在所有的不育个体中,男性不育大约占50%,其中40%~50%存在精子缺陷,如少精症和无精症。人类Y染色体的长臂对于精子的产生是必需的。在三个不同区域的缺失会导至严重的精子缺陷,包括非闭塞的无精子症和精子减少症。这些区域被称为无精子症因子(azoospermiafactor,AZF),三个分离的非重叠区被定义为AzFa、AZFb、AZFc,与产生人类损伤的精子有关。近来的研究证明Yq染色体的微缺失会遗传给其儿子。Yeom等应用多重PCR扩增6个位点,包括Y染色体的性别决定区(sex-determining region on the Ychromosome,SRY)作为阳性对照,无精子症因子区域的5个序列标签位点( sequence-taggedsite,Srs),其中模板是从不育男性血液中提取的基因组DNA。本研究中的引物为Cy3标记,PCR产物可以与固定的探针杂交,提供了一种敏感、高通量检测Y染色体缺失的方法,也是一种男性不育筛选的新方法。
(二)着床前胚胎遗传学诊断(preimplantation genetic diagnosis,PGD)
PGD产生于10多年前,主要目的是识别基因突变或染色体错误引起的遗传性疾病。临床上最早是用来检测夫妻X隐形连锁疾病,随后应用于不同的患者来达到优生优育的目的,主要包括:单基因病携带者,无论显性或隐性、常染色体或X连锁;染色体结构异常携带者,包括易位、翻转、缺失、插入等;避免高龄产妇后代染色体异常;辅助生殖治疗反复植入失败的夫妇反复出现不明原因流产的夫妇。当前PGD已经成为产前诊断(prenatal diagnosis)的一种替代方法。
对于单基因缺陷患者,可以用多重PCR同时扩增多个位点,选择那些位于相同染色体或者临近致病基因的多态性标志位点进行扩增能够有效诊断突变位点和多态性等位基因,可以同时分析多个诊断位点,并且减少错误诊断的概率。另外,还可以扩增高变的指纹位点,指示DNA模板是否被污染
囊性纤维化病(cysticfibrosis,CF)是一种首次成功应用单细胞植入前基因诊断的单基因缺陷性疾病。CF的突变谱差别很大,因此,发展一种突变特异的PGD方法是行不通的。文献[35]建立了一种针对CF通用的多重PCR方法,用于胚胎的遗传学诊断。本研究应用了CF跨膜调控子(cystic fibrosis transmembraneregulator,CFTR)两侧的4个紧密连锁高多态性重复标识:D7S523、D7S486、DS480和D7S90。共检测了100个白细胞和50个卵裂球,其中99%6获得了多重PCR结果,总体等位基因遗失(allelic dropout,ADO)频率从2%~5%不等。确认ADO以及额外等位基因存在后,95%的多重PCR结果可以用来建立基因型标记。基于父母的基因型,考虑到由于变异参数(5%、ADO(0~2%)和单重组(1.1%~3%)造成的胚胎传送丢失,大约90%的胚胎能够应用单个卵裂球进行可靠的PGD基因分型。错误诊断的概率与已知的两侧标识双重组概率相当,小于0.05%。因此,这种多态性和多等位基因标识系统是一种可靠的、可替代直接突变胚胎遗传学诊断的方法。
(三)在遗传修饰生物(genetically modified organisms,GMO)中的应用
近年来可见应用多重PCR技术在转基因成分定性和定量检测的报道。陈文炳等用多重PCR方法在反应体系中加入13对引物同时检测转基因矮牵牛与阳性对照质粒中的1~3个外源基因,包括花榔菜花叶病毒(cauliflower mosaic virus,CaMV)35S启动子、根瘤农杆菌胭脂碱合成酶基因终止子(NOS)、大肠杆菌K12菌株新霉素磷酸转移酶(Npt)编码基因。结果表明,多重PCR不但可以提高检测效率、降低检测成本,还可以有效防止假阳性结果的出现
四)基因重排
免疫球蛋白(immunoglobulin,Ig)和T细胞受体( T cellreceptor,TCR)位点包含很多不同的V、D、J基因片段,参与早期白细胞分化的重排过程。VDJ片段重排由重组酶复合体介导,其中RAG1和RAG2蛋白通过识别、切割DNA重组信号序列(recombination signalsequences,RSs)发挥重要作用,RSS位于V基因下游、D基因两端和J基因上游。不合适的RSS会降低甚至完全阻止重排。 vandongen等成功建立了一种多重PCR方法并将其标准化,能够检测同源细胞重排免疫球蛋白和T细胞受体基因、染色体畸变t(11;14)和t(14;18)。在18个多重FCR反应中,可以使用107对不同的引物进行扩增。14个Ig/TCR和4个BCL/BCL2多重反应体系证明了多重PCR反应完全适合淋巴增生缺陷的克隆研究,并且具有较高的敏感性。特别是在疑似B细胞增殖中与IGH和IGK联合应用,疑似T细胞增殖中与TCRB和TCRG联合应用具有极高的克隆检出率
(五)抗性基因检测
抗生素的广泛使用导至具有耐药性微生物的增多,比如耐甲氧西林金黄色葡萄球菌(methi-cillin resistant Staphylococcus aureus,MRSA)、万古霉素抗性肠球菌(vancomycin resistant enterococcl)和多重耐药结核分枝杆菌( multidrug resistantMycobacteriumtuberculosis)等。这些病原的快速检测及对应的抗生素抗性快速检测对于隔离病人和阻止疾病的进一步蔓延是很重要的。多重PCR方法能够对这些抗生素抗性基因进行同时检测,节省时间,具有较高的敏感性和特异性。
Strohmenger等应用多重PCR方法同时检测金黄色葡萄球菌的9种耐药基因,包括mecA、aacA~anhD、tetK、tetM、emA、emC、wtA、wtB和wC,并且在反应中加入另外对引物,扩增金黄色葡萄球菌的16SrRNA作为阳性对照。通过对分离的3株金黄色葡萄球菌进行检测,多重PCR结果与肉汤微量稀释实验得到的抗性表型一致,证明了多重FCR是一种识别抗生素抗性的快速、简便、精确方法,并且可以用于临床诊断、流行病学研究中用于监测抗性基因的传播还可用多重PCR方法同时检测质粒介导的喹诺酮抗性基因qmA、qrB和qnrS,并用来筛选科威特分离的64株产超广谱内酰胺酶(expanded- spectrum beta-lactamase,ESBL)的肠细菌。
|
 /3
/3 