登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
2015年11月20日,国家食品药品监督管理总局批准了科宁(天津)医疗设备有限公司的乳腺X射线数字化体层摄影设备(型号:KBCT-1000)医疗器械注册。至此,总局公布的按照《创新医疗器械特别审批程序(试行)》批准注册的产品信息如下:
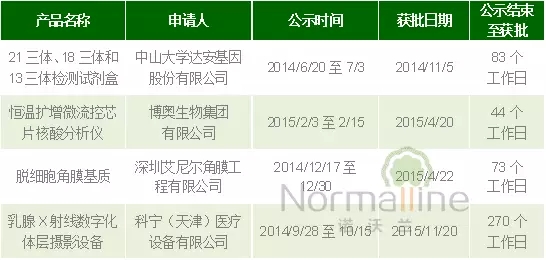
一对比才发现,进入创新产品特别审批通道的产品,其审评审批时限也存在很大差异。可以短至2到4个月上市,也可长至13个月。诺沃兰认为在产品的创新性基本获得认可的情况下,审评时间的长短主要取决于递交资料的质量。 根据总局医疗器械技术审评中心主任孔繁圃题为《医疗器械创新评审准则》的发言,截止到2015年11月20日,总局医疗器械技术审评中心共收到创新医疗器械特别申请一共有274件,其中进口创新医疗器械创新7件,境内创新医疗器械申请涉及19个省市,目前已经完成了249项申请审查工作。37项通过了审查,通过率15%,通过量最多是广东、北京和江苏,通过审查的37项中有源医疗器械24%,无源医疗器械57%,体外诊断试剂19%。16项创新医疗器械的注册申请已经进入了技术审评的程序,其中有7项已经审结(审结产品率仅2.6%)。植入神经刺激系统、多细胞角膜机制等一批高端医疗器械产品相继上市,填补了国内空白,为公众提供了与进口同类产品效果相当,价格更为低廉的医疗产品,降低了诊疗的成本,提高了产品的可及性,为提高公众医疗健康水平发挥了重要的作用。

此前,在总局举办的创新医疗器械培训中,对申请创新产品特别审批程序的失败原因进行了总结,主要原因为以下6点,按照发生频率由高到低依整理为下表,供广大申请人参考。

来源:CMDRA
|  /3
/3 