登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
何时开始申请延续注册? 先来看看法规 《医疗器械监督管理条例》第十五条规定:医疗器械注册证有效期为5年。有效期届满需要延续注册的,应当在有效期届满6个月前向原注册部门提出延续注册的申请。除有本条第三款规定情形外,接到延续注册申请的食品药品监督管理部门应当在医疗器械注册证有效期届满前作出准予延续的决定。逾期未作决定的,视为准予延续。 《医疗器械注册管理办法》第五十四规定:医疗器械注册证有效期届满需要延续注册的,注册人应当在医疗器械注册证有效期届满6个月前,向食品药品监督管理部门申请延续注册,并按照相关要求提交申报资料。除有本办法第五十五条规定情形外,接到延续注册申请的食品药品监督管理部门应当在医疗器械注册证有效期届满前作出准予延续的决定。逾期未作决定的,视为准予延续。 法规明确了延续注册的deadline,即医疗器械注册证有效期届满6个月前,如果注册证有效期只剩5个多月了,您的注册证虽然仍然有效,但是已经不能申请延续了,注册证载明的产品想继续在中国销售必须走其他许可事项。
上述内容大家基本已经达成共识,但是延续注册应该何时启动呢?
由于上述两条法规均提到了“接到延续注册申请的食品药品监督管理部门应当在医疗器械注册证有效期届满前作出准予延续的决定。逾期未作决定的,视为准予延续。”这个“逾期未做决定”究竟应该如何理解? 我们先来回顾一下延续注册的审评审批时限:
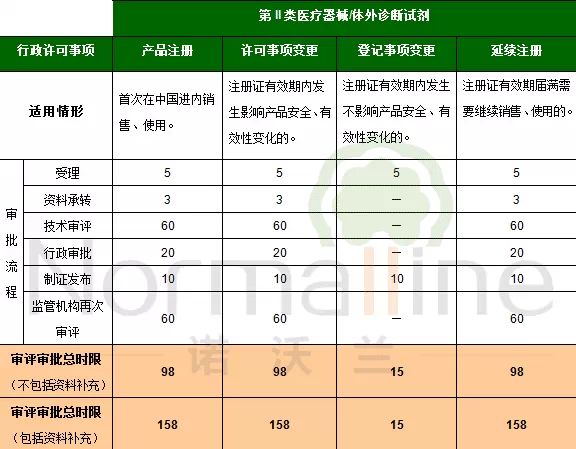
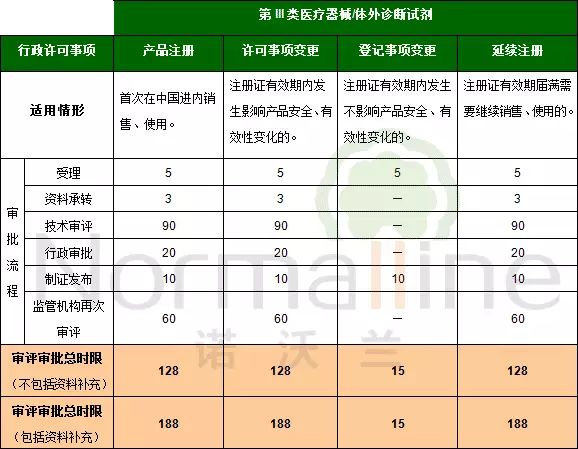
从上图可以看出,如果在技术审评阶段需要补充资料的话,第II类产品延续注册的审评审批总时限为158个工作日(7个月),第III类产品的总时限为188个工作日(8.5个月)。 我们就以第III类医疗器械的延续注册为例。如果企业在注册证有效期届满前6个月的deadline申请延续注册并获得了受理通知书。但是在审评过程中需要补充资料,那么企业很有可能在注册证有效期届满时(6个月)仍未获得监管机构的“准予延续”决定(8.5个月)。那么该产品一旦届满就成了“无证产品”,存在极大的法规风险。
这时候,各位会说,不对呀,法规明明说“逾期未作决定的,视为准予延续”,怎么就成了无证了? 因为法规还说了,《境内第三类和进口医疗器械注册审批操作规范》“延续注册相关要求”部分规定:国家食品药品监督管理总局发出补正资料通知和召开专家会议通知等行为,不属于《医疗器械监督管理条例》第十五条中逾期未作决定的情形。
也就是说延续注册技术审评阶段的“补正资料通知”和“召开专家会议通知”均不属于“逾期未做决定”,因此注册证也就不能“视为准予延续”。如果原注册证已过期失效而新注册证还未获准,就属于无证的状况。 上述情况势必影响企业产品的销售。因此在业内常将 “不影响销售”作为注册证书成功延续的业绩考核指标。所以为实现“不影响销售的证书延续”的目标,通常至少提前12个月而不是6个月启动延续注册申请项目。

来源:CMDRA
|  /3
/3 