登陆有奖并可浏览互动!
您需要 登录 才可以下载或查看,没有账号?立即注册


×
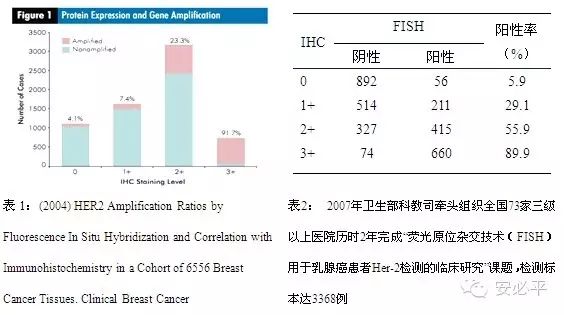
HER2与乳腺癌 乳腺癌是女性恶性肿瘤中发病率最高的一种,正以每年3%~4%的速度急剧上升,已成为女性的第一杀手。临床上大约20-35%的浸润性乳腺癌存在HER2基因的扩增及蛋白的高表达。HER2基因(又名HER2/neu,c-erbB-2)位于17q12,是表皮生长因子受体(HER)家族成员之一,HER家族在细胞生理过程中发挥重要的调节作用。HER2编码相对分子量185KD的跨膜受体样蛋白,具有酪氨酸激酶活性。HER2是重要的乳腺癌预后判断因子,HER2阳性(过表达或扩增)的乳腺癌,其临床特点和生物学行为有特殊表现,治疗模式也与其他类型的乳腺癌有很大的区别。 HER2检测方法有免疫组化(IHC)和荧光原位杂交(FISH)等。《2014年NCCN乳腺癌临床实践指南》和《乳腺癌HER2检测指南2014版》均强调:FISH是检测HER2基因状态的金标准。 一.检测意义 1. 判断预后:HER2阳性的乳腺癌浸润性强,无病生存期短,预后差。 2. 指导治疗:HER2基因扩增的乳腺癌患者对内分泌治疗药物(如他莫昔芬)产生耐药。HER2基因扩增的乳腺癌患者对CMF方案不敏感,宜采用大剂量蒽环类药物和紫杉醇类药物方案;HER2基因扩增的乳腺癌患者明显受益于Herceptin(赫赛汀,2001年FDA批准上市)等靶向药物治疗。 二.检测建议 IHC和FISH检测HER2的状态一致性很高,但也存在着差异,数据统计如下表1和表2示,对于IHC2+样本必须要用FISH进一步确认结果;3+直接为阳性,可不做FISH;0和1+,若条件允许,可再做FISH。
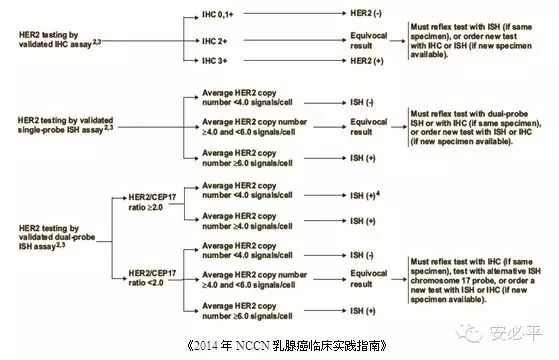
因此,《2014年NCCN乳腺癌临床实践指南》和《乳腺癌HER2检测指南(2014版)》均建议先进行HER2蛋白的IHC检测,IHC 2+样本进行ISH(FISH、DISH或CISH)检测。
三.样本准备: 1.标本类型:(1)手术切除标本;(2)粗针穿刺活检标本;(3)活检标本。 2.标本固定:所有乳腺癌标本离体后都应尽快固定(1h内固定)。固定时应将标本每隔5~10mm切开,并可在组织间嵌入纱布或滤纸等物。固定液量与所浸泡组织的比例应足够。固定时间以6—72h为宜。 3.固定液类型:4%中性(磷酸缓冲)甲醛固定液。 4.组织切片:(1)切片厚度3-5um;(2)应有HE染色切片作为对照。 四.临床上哪些患者需要进行HER2检测 1.所有乳腺原发性浸润癌都应进行HER2检测; 2.只要能获取肿瘤组织,对复发灶或转移灶也应该进行HER2检测; 3.如HER2检测结果为阴性,但疾病复发且生物学行为提示可能为HER2阳性肿瘤时,应重复HER2检测; 4.如HER2检测结果与组织病理学特征不相符时,如组织学分级为I级的浸润性乳腺癌HER2阳性,应重复HER2检测。 组织学1级的类型腺癌: •浸润性导管或小叶癌,ER和PR阳性 •小管癌(至少90%为纯小管癌) •粘液癌(至少90%为纯粘液癌) •筛状癌(至少90%为纯筛状癌) •腺样囊性癌(至少90%为纯腺样囊性癌)且常为三阴性
上一节,我们介绍了HER2检测方法,了解FISH作为金标准方法在HER2检测中的重要意义。这一节我们结合指南中HER2 FISH结果判读方法和临床经验,重点阐述结果判读的要点。 一.信号观察流程 1.首先在HE/IHC切片上确认肿瘤区域; 2.在10×物镜下,于FISH标本上找到与HE染色切片上相同的组织细胞结构; 3.在40×物镜下扫描整张切片,观察是否存在异质性,要求至少找到2个浸润癌区域,计数至少20个浸润癌细胞。满意的标本应是75%以上癌细胞核中有杂交信号; 4.在100×物镜下观察癌细胞核的FISH结果进行信号计数,注意上下调整焦距,以免遗漏信号。 二.实验失败、不能判读的情况 1.因操作等原因,细胞核被损坏,边界不完整; 2.组织过度消化,细胞核边界不完整,DAPI染色浅; 3.组织消化不足,25%以上的细胞核无信号; 4.自发荧光很强或细胞核分辨差,10%细胞核外有信号。 三.计数要求 1.计数区域可结合苏木精伊红染色进行肿瘤细胞标识; 2.选择具较好核分界的区域,要求细胞核大小基本一致、边界完整,DAPI染色均匀、核无重叠,绿色着丝粒信号清晰; 3.随机计数确定的肿瘤区域中20~30个细胞核中的双色信号,不要主观选择信号多的核计数; 4.不要计数仅显示一种颜色信号的细胞核; 5.避免计数分裂像的细胞核或被细胞核分裂及边界不完整核; 6.如果2个同样大小的橘红信号之间距离不足一个常规橘红信号大小,只计为一个信号; 7.若红、绿两信号的比值>20或众多信号连接成簇时可不计数,视为基因扩增; 8.若为临界值,则需要再计数20个细胞核中的信号或由另外一个观察者重新计数,如仍为临界值,则应在FISH检测报告中注明,或换其它方法或其它蜡块重新检测; 9.若HER2基因扩增在不同癌细胞中存在异质性时,应在另一癌区域再计算20~30个癌细胞核中的红、绿信号值,报告其最大值,并加以注释; 10.判读时可以将乳腺组织中的正常细胞(如成纤维细胞、血管内皮细胞、淋巴细胞、正常乳腺上皮细胞)的HER2信号和CSP17信号作为内对照。 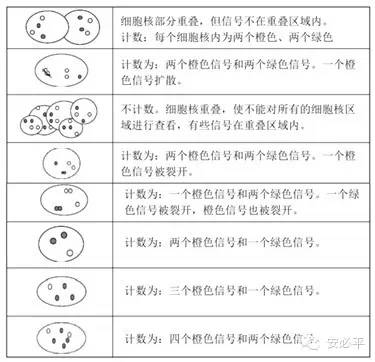

[摘自乳腺癌HER-2基因检测试剂盒(FISH法)说明书—AbbottMoleular Inc.] 四.结果判读 在清晰的肿瘤区域,按以上计数要求在至少20个核内计数GSP HER2(红色)和CSP17(绿色)信号,分别记录GSP HER2和CSP17的信号总数,再计算平均每个细胞HER2拷贝数、平均每个细胞CSP17拷贝数以及GSP HER2和CSP17比值。 
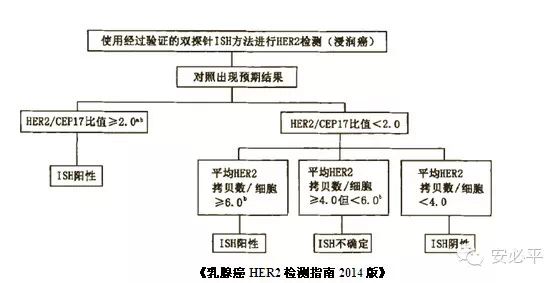
注:a:对于HER2/CSP17比值≥2.0,但平均HER2拷贝数/细胞<4.0的病例是否应该视为FISH阳性目前尚存争议,建议对这部分病例在报告中加以备注,提示目前的争议,建议临床医师参考免疫组织化学检测结果并与患者进行必要的沟通; b:见于均质、连续的浸润细胞,且占浸润癌的10%以上
五.HER2 FISH判读标准的变化 
新旧判读标准的比较: ①2014版新标准的截断值为2.0,2009版老标准的截断值为1.8和2.2; ②2014版新标准不只是HER2/CSP17的比值,需结合HER2基因的拷贝数进行判读;2009版则仅根据HER2/CSP17的比值进行判读,不考虑HER2基因拷贝数。 新旧判读标准衔接中可能出现的问题: ①2014版新标准出现HER2检测结果不确定的情况会比2009版标准更少; ②2014版新标准判读阴阳性结合了HER2基因的拷贝数,有些2009版标准判读结果为阴性的标本,如果HER2基因拷贝数≥6.0,2014版新标准则判为阳性。 [《乳腺癌HER2检测指南2009版》与《乳腺癌HER2检测指南2014版》]
这一节我们依据《乳腺癌HER2检测指南2014版》的要求,进行实例解析。
一.报告要求
《乳腺癌HER2检测指南2014版》要求检测报告包括如下内容:患者信息(包括姓名、 性别、年龄、门诊/住院号)、送检医师姓名、送检日期、标本信息(包括病理号和蜡块号)、标本部位和类型、探针信息、检测方法、是否使用图像分析、对照设置情况、样本量是否适合评估、判读结果(包括评估的细胞数量、平均HER2拷贝数/细胞、平均CSP17拷贝数/细胞、平均HER2拷贝数/平均CSP17拷贝数的比值)、检测结论(如阳性、不确定、阴性、无法判读)。
这里强调两个概念:17号染色体计数和HER2异质性。
1. 17号染色体数目:FISH双探针检测系统中加入CSP17探针的目的是为了在检测HER2基因的同时检测17号染色体数目,从而区分17号染色体的非整倍体与HER2基因扩增。近年来的研究显示17号染色体多倍体与CSP17多信号点(着丝粒区多点)是不同的概念。17号染色体多倍体较罕见,而部分乳腺癌中17号染色体上存在HER2基因和着丝粒区的共同扩增。越来越多的学者认为,与GSP HER2/CSP17比值相比,HER2拷贝数对于HER2基因扩增的判断更为重要。因此在HER2FISH检测结果中除报告GSP HER2/CSP17比值外,还应分别报告HER2拷贝数和CSP17的数值。
2.HER2基因的异质性:浸润性乳腺癌中HER2表达或扩增可存在异质性。虽然HER2基因异质性的临床意义目前仍不明确,但它可导至IHC与ISH检测、原发灶与转移灶、穿刺标本与手术切除标本的检测结果不一致。在ISH计数之前,应观察整张切片或使用IHC确定可能存在HER2扩增的区域。需要强调的是,即使存在异质性,但只要扩增细胞连续、均质,且占浸润癌10%以上,就应明确报告为ISH阳性。在报告中可补充报告不同细胞群(>10%)的计数值(包括计数的细胞总数、HER2拷贝数、CSP17数值、GSP HER2/CSP17比值),并报告扩增细胞群占所有浸润癌细胞的比例。
二.常见结果及解释
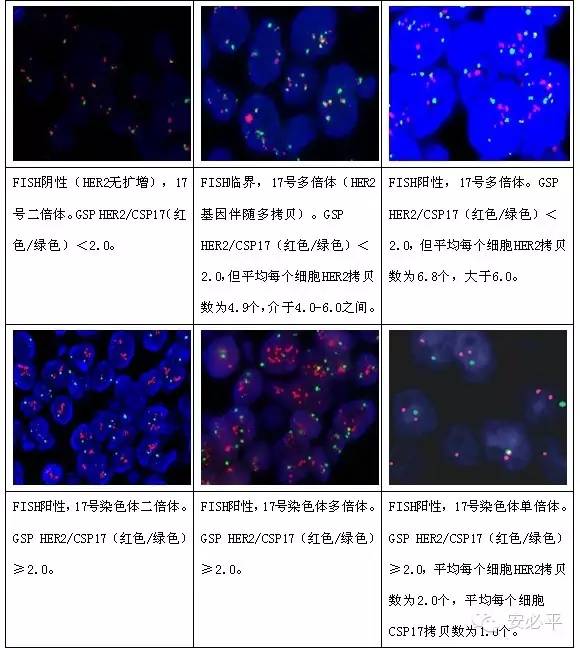
注:对于HER2/CSP17比值≥2.0,但平均HER2拷贝数/细胞<4.0的病例是否应该视为FISH阳性目前尚存争议,建议对这部分病例在报告中加以备注,提示目前的争议,建议临床医师参考免疫组织化学检测结果并与患者进行必要的沟通
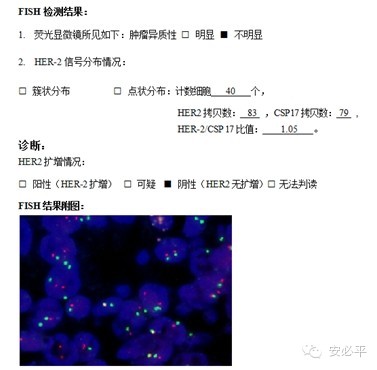
三.报告模板参考
1. 参考模板一
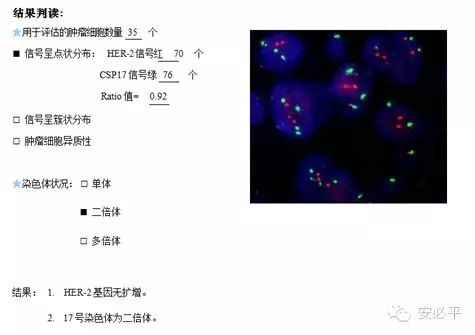
2. 参考模板二
本文转自“安必平” |  /3
/3 