1、技术原理和技术特点ELISPOT全名为酶联免疫斑点检测,英文:Enzyme-linked Immunospot Assay。它结合了细胞培养技术与酶联免疫吸附技术(即ELISA技术),能够在单细胞水平检测细胞因子的分泌情况。其技术原理,一句话概括就是:用抗体捕获培养中的细胞分泌的细胞因子,并以酶联斑点显色的方式将其表现出来(Sedgwick JD 2005)。该技术检测细胞因子具有三大优点:其一,灵敏度高。在一百万个阴性细胞中只要有一个分泌细胞因子的阳性细胞即可被检测出来。这是目前为止,最为灵敏的检测技术,灵敏度比传统的的ELISA方法高2-3个数量级。其二,单细胞水平,活细胞功能检测。ELISPOT检测的是单个细胞分泌,而非细胞群体的平均分泌。在检测的过程中,有活细胞培养与抗原刺激阶段,检测的是活细胞的功能,而非死细胞的遗留物。其三,操作简便经济,可以进行高筒量筛选。ELISPOT没有复杂的细胞体外扩增过程,不使用同位素,不需要大型的、专门的实验仪器设备。按照标准化的实验操作,一个实验者可以同时处理数百个样品,效率远远高于其它检测方法(Kalyuzhny AE 2005)。实验设计在96孔培养板上进行,直接以培养板的塑料板底或者PVDF膜以及硝酸纤维素膜为基质,包被上特异性的单克隆抗体,用以捕获细胞分泌的细胞因子。(由于涉及到细胞培养的过程,对单克隆抗体的要求要远高于ELISA中的捕获抗体,该抗体需要无毒,不含内毒素,亲和力高等特点。)之后,在培养板的孔内加入细胞培养基(现在无血清ELISPOT技术已经成熟,培养基中可以不再含有血清)、待检测的细胞以及抗原刺激物进行培养。在特异性的抗原或者非特异性的有丝分裂原的刺激下,数小时之内,T细胞就会开始分泌各种细胞因子。细胞因子当即就被位于细胞下方的膜上的单克隆抗体所捕获。在洗去细胞之后,被捕获的细胞因子可以与生物素标记的第二抗体结合,然后用酶标亲和素再与生物素结合,进行化学酶联显色,就可以在膜的局部形成一个个圆形的斑点。每一个斑点就对应了当初一个分泌细胞因子的细胞,这些细胞被称为斑点形成细胞(Spots forming cells SFCs)。统计膜上的斑点的数目,再除以当初加入孔内的细胞总数,就可以计算出阳性细胞的频率。 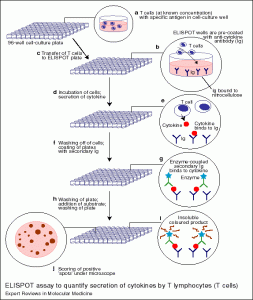 2、ELISPOT的发展历史ELISPOT方法从创立至今已经有20多年的历史了。1983年,在地球南北两个半球地理位置相距遥远的两个研究小组几乎同时、独立的创立了这项技术。一个研究小组位于澳大利亚西部的柏斯Peth,牵头人是当时正在当地Margaret女王医院儿童医学研究所攻读博士学位的Jonathon D. Sedgwich (Sedgwick JD et. al., 1983)。另一个研究小组位于北欧瑞典城市哥德堡Gothenburg,带头人是哥德堡大学医学微生物系的学者Cecil C. Czerkinsky (Czerkinsky CC et. al., 1983a)。前者开创ELISPOT方法是为了研究B淋巴细胞分泌IgM抗体的情况(Holt PG et. al., 1984;Sedgwick JD et. al., 1984);而后者除了用于研究B淋巴细胞分泌抗体的情况(Czerkinsky CC et. al., 1983b; 1983c),还应用于大肠杆菌分泌肠毒素(Czerkinsky CC et.al., 1983a)和成纤维细胞分泌纤维连接蛋白(Czerkinsky CC et. al., 1984)的研究中。虽然研究的对象不一样,但是该实验技术所涉及的原理以及方法步骤和我们现在的标准ELISPOT几乎完全相同。这二十多年来,ELISPOT基本技术并没有什么重大变化,但是技术进步一直没有停顿,实验材料的改进了,实验灵敏度与重复性提高了,实验应用领域也拓宽了。(1)底板材质的改进ELISPOT技术从创立之初,检测底板都是使用的普通塑料板,它的蛋白吸附能力差,因此实验的灵敏度有限。1985年,Moller SA和Borrebaeck CA 将膜板引入ELISPOT中(Moller SA et. al., 1985),检测的也是分泌抗体的阳性B细胞。他们引入的是硝酸纤维素膜,获得了远远优于塑料板的结果。1995年,荷兰Utrecht大学免疫研究所的Schielen P团队(该团队后来挂靠Utrecht大学,创办了荷兰U-Cytech公司,成为世界上顶级的ELISPOT试剂盒生产商之一)把一种更优于硝酸纤维素膜的PVDF膜也被引入了ELISPOT检测中(Schielen P et. al., 1995)。做过Westernblot的人都知道,PVDF膜比硝酸纤维素膜有更优的蛋白吸附性质,更加精细的显色条带分辨率。因此,PVDF的引入是继硝酸纤维素膜之后,ELISPOT底板材料的又一次重大突破(McCutcheon M et. al., 1997)。至今,PVDF膜几乎完全取代了NC膜(Weiss AJ 2005)。“反者道之动”。塑料板在被膜板取代之后,沉寂了许多年,现在又开始兴旺起来了(Ronnelid J et. al., 1997; Okamoto Y et. al., 1997)。最著名的塑料ELISPOT板当数荷兰U-Cytech公司研发的透明板,已经成为了该公司的一大特色。塑料ELISPOT板的重新兴旺有两个方面的原因:一方面是技术进步,在塑料材质的改进之后,板底吸附蛋白的能力已经比传统的塑料板有了很大提高,虽然还赶不上膜板,但是应付ELISPOT实验已经绰绰有余。更高质量的抗体也有利于塑料板获得更好的ELISPOT结果。另一方面归因于塑料板自身的优势,相对低廉的价格,简化的操作步骤,简短的实验时间都是塑料板的优势(Ronnelid J et. al., 1997)。此外对于透明板,还可以在实验中随时观察细胞的状态与密度,这对新手是很重要的。(2) 检测内容的多样化在ELISPOT技术创立之初,主要用于检测B淋巴细胞分泌的抗体,包括各种类型的免疫球蛋白,包被的材料是特异性的抗原或者抗体的抗体(Holt PG et. al., 1984;Sedgwick JD et. al., 1984)。B细胞分泌的抗体一般的量比较大,容易检测,即使早期ELISPOT检测的灵敏度不够高,检测大量分泌的抗体还是不成问题的(Bjorkander J et. al., 1991; Ahlfors E et. al., 1991; Holmgren J et. al., 1992a)。时至今日,ELISPOT检测还广泛地用来研究粘膜免疫中的抗体分泌情况(Holmgren J et. al., 2005)。后来随着技术的进步,ELISPOT检测的灵敏度有了大幅度的提高,以至于可以检测到痕量的细胞因子,于是它的主要应用就转移到检测细胞因子上来了(Czerkinsky C et.al,. 1988a; 1991; Hutchings PR et. al., 1989)。现在各种常见细胞因子的检测都有了商业化的试剂盒,使用起来非常方面。能商业化检测的细胞因子包括人类、小鼠、大鼠、猴子、猩猩的干扰素(γ-IFN)、白介素(IL-2,4,5,6,10,12等)、颗粒酶(Granzyme B)、肿瘤坏死因子(TNF-α)。目前全球ELISPOT试剂盒的主要供应商有:荷兰U-CyTech公司、瑞典Mebtech公司、法国Diaclone公司、美国BD Pharmingen公司和R&D公司。他们的产品各有特点,其中荷兰U-CyTech公司的产品质优价廉,在国内市场居于主导地位。(3) 多细胞因子的检测通常的ELISPOT检测每个孔只检测一种细胞因子。如果要在一个ELISPOT孔内同时检测两种或者两种以上的细胞因子,可以包被两种抗体以捕获两种细胞因子,然后用两种不同的酶联抗体以及显色剂显出两种斑点来。早在1988年,Cecil C. Czerkinsky就提出并且实现了这种想法(Czerkinsky C et.al,. 1988b)。但是,双色ELISPOT有一个与生俱来的弱点,那就是斑点分离的问题。大家知道,斑点的混合色属于物理学上“颜料的三原色”问题,两种不同颜色的颜料如果以不同的比例混合,会出现一系列不同的表观颜色。其中的细微差异,人的肉眼有时候都难于判断,何况是自动的读板仪。所以,在双色ELISPOT斑点识别上,总会有些混色的斑点无法正确的识别与分类。为了解决这个难题,人们想到了用荧光元及检测ELISPOT的方法(Ruedl C et. al., 1994; Sarawar SR et. al., 1994)。不同颜色的荧光混合在一起,只要加一张滤光片,就可以精确的滤出目标荧光,而遮蔽掉其它颜色的荧光,荧光之间可以互不干扰。这对于双因子,甚至多因子ELISPOT检测都是十分理想的手段(Gazagne A et. al., 2005)。但是荧光ELISPOT检测目前还有不足之处。由于荧光素直接偶联在抗体或者亲和素上,缺乏酶催化底物的那种放大作用,所以灵敏度还无法和化学显色的ELISPOT方法比较(Gazagne A et. al., 2005)。此外,硝酸纤维素膜自身在激发下就会发荧光,所以不适合做荧光ELISPOT底板材料。PVDF膜也有自身发荧光的问题,虽然不像硝酸纤维素膜那样严重,但是也会造成背景升高,信噪比下降的问题(Gazagne A et. al., 2005)。荷兰U-Cytech公司已经发开出了新一代的荧光底板介质Hydrogel™,它既有很高的抗体吸附性质,又没有荧光背景。Hydrogel™目前存在的唯一问题是保存起来不够稳定,限制了它的推广。综上所述,多细胞因子检测是ELISPOT未来的一个发展方向,但在技术上还不够成熟,有待于改进。 2、ELISPOT的发展历史ELISPOT方法从创立至今已经有20多年的历史了。1983年,在地球南北两个半球地理位置相距遥远的两个研究小组几乎同时、独立的创立了这项技术。一个研究小组位于澳大利亚西部的柏斯Peth,牵头人是当时正在当地Margaret女王医院儿童医学研究所攻读博士学位的Jonathon D. Sedgwich (Sedgwick JD et. al., 1983)。另一个研究小组位于北欧瑞典城市哥德堡Gothenburg,带头人是哥德堡大学医学微生物系的学者Cecil C. Czerkinsky (Czerkinsky CC et. al., 1983a)。前者开创ELISPOT方法是为了研究B淋巴细胞分泌IgM抗体的情况(Holt PG et. al., 1984;Sedgwick JD et. al., 1984);而后者除了用于研究B淋巴细胞分泌抗体的情况(Czerkinsky CC et. al., 1983b; 1983c),还应用于大肠杆菌分泌肠毒素(Czerkinsky CC et.al., 1983a)和成纤维细胞分泌纤维连接蛋白(Czerkinsky CC et. al., 1984)的研究中。虽然研究的对象不一样,但是该实验技术所涉及的原理以及方法步骤和我们现在的标准ELISPOT几乎完全相同。这二十多年来,ELISPOT基本技术并没有什么重大变化,但是技术进步一直没有停顿,实验材料的改进了,实验灵敏度与重复性提高了,实验应用领域也拓宽了。(1)底板材质的改进ELISPOT技术从创立之初,检测底板都是使用的普通塑料板,它的蛋白吸附能力差,因此实验的灵敏度有限。1985年,Moller SA和Borrebaeck CA 将膜板引入ELISPOT中(Moller SA et. al., 1985),检测的也是分泌抗体的阳性B细胞。他们引入的是硝酸纤维素膜,获得了远远优于塑料板的结果。1995年,荷兰Utrecht大学免疫研究所的Schielen P团队(该团队后来挂靠Utrecht大学,创办了荷兰U-Cytech公司,成为世界上顶级的ELISPOT试剂盒生产商之一)把一种更优于硝酸纤维素膜的PVDF膜也被引入了ELISPOT检测中(Schielen P et. al., 1995)。做过Westernblot的人都知道,PVDF膜比硝酸纤维素膜有更优的蛋白吸附性质,更加精细的显色条带分辨率。因此,PVDF的引入是继硝酸纤维素膜之后,ELISPOT底板材料的又一次重大突破(McCutcheon M et. al., 1997)。至今,PVDF膜几乎完全取代了NC膜(Weiss AJ 2005)。“反者道之动”。塑料板在被膜板取代之后,沉寂了许多年,现在又开始兴旺起来了(Ronnelid J et. al., 1997; Okamoto Y et. al., 1997)。最著名的塑料ELISPOT板当数荷兰U-Cytech公司研发的透明板,已经成为了该公司的一大特色。塑料ELISPOT板的重新兴旺有两个方面的原因:一方面是技术进步,在塑料材质的改进之后,板底吸附蛋白的能力已经比传统的塑料板有了很大提高,虽然还赶不上膜板,但是应付ELISPOT实验已经绰绰有余。更高质量的抗体也有利于塑料板获得更好的ELISPOT结果。另一方面归因于塑料板自身的优势,相对低廉的价格,简化的操作步骤,简短的实验时间都是塑料板的优势(Ronnelid J et. al., 1997)。此外对于透明板,还可以在实验中随时观察细胞的状态与密度,这对新手是很重要的。(2) 检测内容的多样化在ELISPOT技术创立之初,主要用于检测B淋巴细胞分泌的抗体,包括各种类型的免疫球蛋白,包被的材料是特异性的抗原或者抗体的抗体(Holt PG et. al., 1984;Sedgwick JD et. al., 1984)。B细胞分泌的抗体一般的量比较大,容易检测,即使早期ELISPOT检测的灵敏度不够高,检测大量分泌的抗体还是不成问题的(Bjorkander J et. al., 1991; Ahlfors E et. al., 1991; Holmgren J et. al., 1992a)。时至今日,ELISPOT检测还广泛地用来研究粘膜免疫中的抗体分泌情况(Holmgren J et. al., 2005)。后来随着技术的进步,ELISPOT检测的灵敏度有了大幅度的提高,以至于可以检测到痕量的细胞因子,于是它的主要应用就转移到检测细胞因子上来了(Czerkinsky C et.al,. 1988a; 1991; Hutchings PR et. al., 1989)。现在各种常见细胞因子的检测都有了商业化的试剂盒,使用起来非常方面。能商业化检测的细胞因子包括人类、小鼠、大鼠、猴子、猩猩的干扰素(γ-IFN)、白介素(IL-2,4,5,6,10,12等)、颗粒酶(Granzyme B)、肿瘤坏死因子(TNF-α)。目前全球ELISPOT试剂盒的主要供应商有:荷兰U-CyTech公司、瑞典Mebtech公司、法国Diaclone公司、美国BD Pharmingen公司和R&D公司。他们的产品各有特点,其中荷兰U-CyTech公司的产品质优价廉,在国内市场居于主导地位。(3) 多细胞因子的检测通常的ELISPOT检测每个孔只检测一种细胞因子。如果要在一个ELISPOT孔内同时检测两种或者两种以上的细胞因子,可以包被两种抗体以捕获两种细胞因子,然后用两种不同的酶联抗体以及显色剂显出两种斑点来。早在1988年,Cecil C. Czerkinsky就提出并且实现了这种想法(Czerkinsky C et.al,. 1988b)。但是,双色ELISPOT有一个与生俱来的弱点,那就是斑点分离的问题。大家知道,斑点的混合色属于物理学上“颜料的三原色”问题,两种不同颜色的颜料如果以不同的比例混合,会出现一系列不同的表观颜色。其中的细微差异,人的肉眼有时候都难于判断,何况是自动的读板仪。所以,在双色ELISPOT斑点识别上,总会有些混色的斑点无法正确的识别与分类。为了解决这个难题,人们想到了用荧光元及检测ELISPOT的方法(Ruedl C et. al., 1994; Sarawar SR et. al., 1994)。不同颜色的荧光混合在一起,只要加一张滤光片,就可以精确的滤出目标荧光,而遮蔽掉其它颜色的荧光,荧光之间可以互不干扰。这对于双因子,甚至多因子ELISPOT检测都是十分理想的手段(Gazagne A et. al., 2005)。但是荧光ELISPOT检测目前还有不足之处。由于荧光素直接偶联在抗体或者亲和素上,缺乏酶催化底物的那种放大作用,所以灵敏度还无法和化学显色的ELISPOT方法比较(Gazagne A et. al., 2005)。此外,硝酸纤维素膜自身在激发下就会发荧光,所以不适合做荧光ELISPOT底板材料。PVDF膜也有自身发荧光的问题,虽然不像硝酸纤维素膜那样严重,但是也会造成背景升高,信噪比下降的问题(Gazagne A et. al., 2005)。荷兰U-Cytech公司已经发开出了新一代的荧光底板介质Hydrogel™,它既有很高的抗体吸附性质,又没有荧光背景。Hydrogel™目前存在的唯一问题是保存起来不够稳定,限制了它的推广。综上所述,多细胞因子检测是ELISPOT未来的一个发展方向,但在技术上还不够成熟,有待于改进。
二、 ELISPOT的方法由于有商品化的试剂盒,ELISPOT操作本身已经大大简化。目前的ELISPOT试剂盒按抗体的包被情况分为已包被板的和未包被板的两类。前者实验操作简单,但是背景较高,且价格较贵,所以应用不如后者广泛。按照ELISPOT底板材料分,可以分为PVDF膜板和非PVDF膜板。PVDF板由于疏水性的问题,需要用乙醇预先润湿,在洗涤过程中也更复杂一些。各个公司的试剂盒使用起来大同小异,我们以荷兰U-Cytech公司的PVDF板IFN-γ 试剂盒威力,列出其操作方法。1、实验的准备工作(1) 设备与耗材:超净工作台;5% CO2 37°C 细胞培养箱;P20, P200, P1000 微量移液器;P300 8通道微量移液器,P300 12通道微量移液器;Biosys ELISPOT ReaderP20, P200, P1000 枪头;多道移液器吸槽;0.5mL,1.5mL EP管。(2)溶液配制PBS: 用分析纯试剂,millipore.html' target='_blank'>Millipore级别的纯水配制,高压灭菌。PBST: PBS加入0.05% Tween-20,注意无菌操作。储存于20-25°C,可存放一个月。70%乙醇:分析纯乙醇70mL,加入Millipore级别的纯水至100mL。30%乙醇:分析纯乙醇30mL,加入Millipore级别的纯水至100mL。包被抗体(coating antibody,Primary antibody):照U-Cytech说明书,加入双蒸水溶解。使用时,用PBS稀释50倍,每孔50μL。封闭液:用PBS将试剂盒中的封闭存储液(Blocking stock solution R)稀释10倍,每孔200μL。抗体稀释液:注意,只是用来稀释检测抗体和酶联亲和素。用PBS将试剂盒中的稀释存储液(Dilution buffer R)稀释10倍检测抗体(Biotinylated detector antibody,Secondary antibody):照U-Cytech说明书,加入双蒸水溶解。使用时,用抗体稀释液稀释100倍,每孔100μL。酶联亲和素(Streptavidin-HRP conjugate):照U-Cytech说明书,加入双蒸水溶解。使用时,用抗体稀释液稀释100倍,每孔100μL。AEC显色液: 照U-Cytech说明书,用100mL 30%乙醇溶解底物缓冲液胶囊(Substrate buffer capsule),然后加入3.3mL AEC储存液(AEC stock solution),混合均匀后10mL每支分装,-20oC保存。使用时,解冻,每孔加入100μL。PHA刺激物: 将储存液(2mg/ml, Murex)分装成20μL/EP管,-20°C长期冻存。使用时,加入980μL U-Cytech无血清培养基(或者1640基本培养基),成为工作液(40μg/mL,10倍终浓度),每孔加入10μL,终浓度4μg/mL。U-Cytech无血清培养基:我们推荐无血清ELISPOT技术,它能排除血清的干扰,结果更加稳定可靠,背景也更好。如果没有,可以用含10% 血清的1640培养基代替。
2、ELISPOT标准操作程序(1)第一天:ELISPOT包被程序设计好试验,把每个孔要加入的内容做成卡片,到时候就会从容很多。每孔加入15μL 70%的乙醇预湿30秒。注意:未润湿的PVDF膜是洁白的、不透明的,经过乙醇润湿之后,颜色变暗,变成半透明状,很容易观察二者的区别。加乙醇的时候,枪头应该靠在孔壁接近孔底的地方,注意枪头不到刺到PVDF膜。有时候,加入的乙醇挂在孔壁上,这时要盖上板盖,轻轻叩击,让乙醇顺势滑落。乙醇一旦接触到PVDF膜,就会在表面张力和毛细作用之下迅速浸润整块膜,使得膜的颜色和透明度发生变化。15μL是经过优化的体积,它能保证刚好完全浸润整块膜,而不会有剩余。如果加大使用量,乙醇溶液就会透过膜而积存在膜的背面,加深实验的背景。加入100μL去离子水洗涤三次,尽量减少乙醇的残留。按照试剂盒的使用说明,将包被抗体储存液稀释在PBS缓冲液中,每孔加入50μL,4°C包被过夜。(次日)倾倒包被液,用PBS洗涤5次,最后一次,在灭菌的吸水纸上扣干。加入200μL试剂盒自带的稀释好的封闭液,37°C封闭1小时。倾倒封闭液,无须洗涤,直接可以进行细胞培养。(也可以用PBS缓冲液或者纯水洗涤一次,拍干,封口,4°C保存,可以在4°C保存数周。)(2)第二天:铺细胞,加入刺激物,培养整个实验设置一组正对照(PHA刺激),每一个细胞样品(同一个捐献者或者实验动物)要设一个负对照(不加刺激物),整块板还要加一个背景负对照(不含细胞,只加培养基和所有的检测试剂)。填好实验卡片,用以指导实验的安排和细胞及试剂的添加。每一个细胞/刺激物的组合设置2-4个孔的重复(想要有统计学的意义,每个细胞/刺激物设4 个孔的重复)。取出封闭好的板,准备加入细胞。如果是以前做的封闭,可以加入200μL的U-Cytech无血清培养基,室温静置10分钟,倾倒,然后再重复一次。按照实验卡片的安排,加入不同浓度的细胞,100μL/well,细胞在孔中的分布要尽量均匀(要诀是加入细胞之后,不要再震动或者拍击 ELISPOT板。有人认为拍击板子会让细胞更分散,实际情况刚好相反)。正对照的细胞浓度为1x105/well,实验组的样品细胞浓度请自行调整。加入100μL的U-Cytech无血清培养基到背景负对照孔。正对照孔加入10μL PHA,终浓度4ug/mL,该浓度能有效刺激IFN-γ的分泌。加入实验者自己的刺激物(配制成10X终浓度,10μL/well)到实验孔。加完刺激物之后不要再拍击ELISPOT板。有人认为拍击板子会让刺激物在孔中混合均匀,实际上,通过扩散,刺激物也会很快混合均匀。拍击板子会让细胞成圈的分布在孔的外周。当加完所有的样品之后,盖上板盖,放入二氧化碳培养箱,37°C培养18-24小时。注意在整个培养过程中避免移动、碰撞培养板。为了取得更好的结果,甚至开关培养箱的箱门也应该禁止。因为碰撞会造成细胞的移位,造成斑点的模糊、拖尾。(3) 第三天:培养后操作倾倒孔内的细胞及培养基。低渗法将细胞裂解,每孔加入200μL冰冷的去离子水,将板置于冰上冰浴10分钟。每孔用200μLPBST洗涤10遍,洗涤最后一遍之后,将板倒扣在吸水纸上拍干。按照试剂盒说明的浓度,用抗体稀释液稀释检测抗体,每孔加入100μL生物素标记的检测抗体,37°C 1小时。每孔用200μL PBST洗涤5遍,洗涤最后一遍时,将PVDF膜板的背面的塑料保护层取下,同时洗涤膜的正反两面,盖上保护层,将板倒扣在吸水纸上拍干。注意:洗涤膜的背面,我们摸索出的办法是,在一个浅托盘中盛上干净的PBST,将膜板的底面浸入,轻轻摇晃几次即可。注意,一定要将膜的背面和塑料保护层上的液体甩干之后,再合拢,盖上,不要伤害到膜。按照试剂盒说明的浓度,用抗体稀释液稀释酶标的链霉亲和素,每孔加入100μL,37°C 1小时。每孔用200μL PBST洗涤5遍,洗涤最后一遍时,将PVDF膜板的背面的塑料保护层取下,同时洗涤膜的正反两面,盖上保护层,将板倒扣在吸水纸上拍干。照试剂盒的说明,解冻已配好的AEC显色液。每孔加入100μL的显色液,室温静置20-30分钟,注意避光。待斑点生长到适合的大小之后,以去离子水洗涤2遍,终止显色过程。将板倒扣在吸水纸上,拍干细小的水珠,之后取下保护层,放在通风的地方,室温静置 10-30分钟,让膜自然晾干。注意不要将板放到烤箱内,防止膜发脆、破裂。将ELISPPOT板置于Biosys Bioreader4000 PRO自动读板仪内,调节好合适的参数,半点计数,并记录斑点的各种参数,作统计分析。
三、 ELISPOT检测的标准化与质量控制由于ELISPOT检测的超高灵敏度,它的斑点形成容易受到诸多因素的影响。如果不采取措施,检测的重复性很难保证,不同实验室、不同操作者、甚至同一操作者不同批次之间的结果也很难进行直接比较和汇总。1、ELISPOT技术的标准化为了提高ELISPOT检测结果的可重复性,增加实验的可信度,必须建立一套标准化的实验操作规范(Janetzki S et. al., 2005)。标准化的实验操作规范不仅仅是一些实验操作,更是一个系统工程,需要提升到实验室管理与制度架构上来建设。这包括实验室制度的建立,实验人员的培训,实验程序的建立和标准化,实验设备、试剂、耗材的选择与标准化等等。单就实验流程而言,标准化规范从实验样品的采集阶段就开始了,一直延续到整个实验的结束,即数据分析处理的完成(Janetzki S et. al., 2005)。影响到ELISPOT斑点频率的因素很多,但是最重要的影响因素可以归结为三个:其一,被检测细胞的状态;其二,整个实验过程中细胞所接触到的内毒素以及其它敏感成分;其三,刺激物的质量与纯度。(1) 细胞状态这是一个很难量化的主观概念。尽管量化困难,但是长期做ELISPOT检测的实验者都能够感觉到:凡是状态好、活力高、功能保持完好的细胞,ELISPOT检测时必定背景干净,负对照斑点少,实验组的斑点圆润漂亮,并且结果的可重复性好,数据真实可信。反之亦然。如何保持细胞的良好状态呢?根据不用的情况有不用的应对措施。做ELISPOT检测的细胞可以分为两类,一类是新鲜分离的细胞,还有一类是经过冻存复苏的细胞。对于前一类细胞,为让细胞始终处于最佳的状态,需要采取经过优化的、标准化的细胞分离方法,经量减少机械损伤(比如通过机械方法将小鼠的脾脏分解成单个细胞)和有毒的化学物质(比如淋巴细胞分离液)对细胞的损害。而对于冻存复苏的细胞,情况就更加复杂了。冻存与解冻对细胞本身就是很大的伤害。在细胞冻存中还会使用一些保护剂(比如DMSO),能减少冻存对细胞的伤害,但是这些保护剂本身就具有生物毒性,也会伤害细胞,影响细胞的状态。可是说,ELISPOT技术对细胞的冻存与复苏提出了更加严格的要求,不单单要求细胞的存活率高,还要求细胞的免疫功能在冻存前后不发生改变。因此,传统的细胞冻存、复苏方法已经不能适应新的要求了。国外较早开展这方面的研究,从理论与实践上已经摸索出了一套行之有效的适应ELISPOT功能检测要求的细胞冻存、复苏方法,可以保证很高的存活率(90%),并且斑点形成细胞SFC频率保持不变(Maecker HT et. al., 2005)。有些公司已经把细胞冻存、复苏程序经过优化而固定下来了,还开发了相应的细胞冻存液,可以对细胞提供额外的保护。比如荷兰U-Cytech公司推出的冻存液,专门针对做ELISPOT检测的细胞,辅以标准化的冻存、复苏程序,效果卓越。(2)内毒素内毒素,即使是很低的浓度,也可以非特异性的刺激T淋巴细胞,使其分泌细胞因子。所以它对ELISPOT斑点频率有着非常大的影响。控制 ELISPOT检测中的活细胞所接触到的内毒素,要从各个关口严格控制。最先控制的是ELISPOT试剂,要选择口碑好的、产品内毒素含量低的产品。其次要控制培养基和血清。最好选购低内毒素的产品,每一批次要做验证。最后,要控制整个实验操作,做到严格无菌。特别指出的是血清,除了含有内毒素,会增加负对照的斑点数目之外,还可能含有其它未知ELISPOT敏感成分,或者增加或者抑制斑点的生成。这在以往的报道中已经屡见不鲜。为了彻底解决这一问题,最好采用无血清ELISPOT技术。即在ELISPOT刺激孵育中使用不含血清的培养基。目前,适用于人的PBMC细胞的无血清培养技术已经成熟,荷兰U- Cytech公司开发了专门针对于人的PBMC细胞的ELISPOT无血清培养基,化学成分完全限定,和ELISPOT兼容,完全消除了血清对检测的干扰作用。(3)刺激物选择特异性的刺激物,有一个原则,那就是:成分尽可能简单,纯度尽可能高。所有首推T细胞表位肽。它的成分简单,特异性也最好。但是由于涉及到 MHC分子类型匹配的问题,如果不知道实验对象的MHC类型的话,可能要多选择几个T细胞表位肽,验证实验效果。其次推荐重叠多肽池。如果没有抗原蛋白的 T细胞表位信息,也无相应的文献可以参考,那最好选择重叠多肽池。目前的生物信息学有了长足的发展,可以帮我们预测蛋白质序列上潜在的T细胞表位肽,根据预测的结果,在潜在的T细胞表位肽附近和成一系列的重叠多肽,混合成多肽池,也能对特异性的细胞免疫反应作出有效刺激。以上两类多肽都是人工合成的,特别要注意合成的纯度(最好在90%以上,越纯越好)以及合成过程中的质量控制,注意避免内毒素的污染。再次一级的刺激物是重组蛋白。注意,在大肠杆菌中重组表达的蛋白质完全不可用。因为它含有的大肠杆菌成分以及内毒素高到让人无法接受的水平。最好是选择在哺乳动物细胞中表达的蛋白质,它与ELISPOT的相容性最佳。昆虫杆状病毒载体表达的蛋白纯度比较高,也可以使用。如果使用酵母载体表达的蛋白,需要多做验证,有时候效果也会比较好。如果实在没有办法获得化学成分单一且已知的抗原刺激物而被迫使用成分未知的提取物的话,一定要注意多做验证,多做对照,多做重复孔。一般来说,这类刺激物会产生很多非特异性的斑点,在不同的实验对象个体之间会产生很大的差异,属于不得已而为之。2、ELISPOT检测的质量控制仅仅只有标准化的操作规范,不同实验者、不同实验室的ELISPOT结果还无法直接相互比较。为了做到这一点,还需要有一种定量的质控系统。目前,在国际上的艾滋病疫苗项目需要在不同的国家、不同的实验是共同实施完成。为了评估疫苗的效果,在做ELISPOT质量控制时,采取了核心参比实验室质控的方法(Janetzki S et. al., 2005)。即让分布在各个地方的前线实验室将有代表性的样品细胞冻存,运输到核心实验室,核心实验室统一对代表样品做ELISPOT检测,以这个检测结果和各个实验室自己的实验结果作比较和校正,然后汇总校正过的全局实验结果。这种定量质控的方式可以称之为“收上来”的质控方式。还有一种相对的定量质控方式。即在一个核心实验室制备号标准品(包括标准刺激物和冻存细胞),然后分发到参与质量控制的各个前线实验室。各个实验在做ELISPOT检测的同时也顺带做上标准品的检测。如果标准品的实验结果在预先设定的范围之内,那么前线实验室的该批ELISPOT检测结果就是可信的,可接受的。如果各个前线实验室的检测都以同一种标准品做质控,并且在质控范围之内,那么这些实验室之间的ELISPOT结果就是可以相互比较的,能够共同参与实验数据的统计分析。ELISPOT数据处理与自动读板设备ELISPOT检测的最终数据是细胞频率,即在细胞群体中,受某种特异性抗原的刺激而分泌某种细胞因子的阳性细胞的比例。细胞的总数在一开始已经技术过了。需要统计的是阳性细胞(也称斑点形成细胞spot forming cell SFC)数目。根据以前的技术研究,我们可以肯定,每一个ELISPOT斑点对应唯一一个阳性细胞。所以ELSPOT数据处理最重要的工作就是进行斑点计数。
手工计数一般是使用双筒解剖镜,在放大25倍的解剖镜下,一个孔的底板刚好覆盖一个完整的视野。实验操作人员手持按压式的计数器,对孔内的斑点逐一计数。手工计数最大的优点就是可以利用人脑的智慧与经验:比如可以适应各种大小的斑点,排除各种假阳性的斑点,能辨认复杂的背景下的模糊的斑点,等等。 但是手工计数也有致命的弱点,那就是工作乏味,费时费力。尤其是在实验规模比较大、斑点频率比较高的时候(比如有数快板,每孔有数百乃至上千个斑点),人工计数简直就是实验者的噩梦!此外,人工计数的主观差异也是一个问题,实验者很难在整个计数过程中保持完全相同的斑点判定标准。要实现这个过程的自动化,我们很容易想到显微照相技术、图像处理技术以及计算机人工智能技术。把它们综合到一起,这就是ELISPOT自动读板设备。1992年,德国莱卡公司推出了第一台ELISPOT自动读板仪。然而市场却没打开,因为那时的ELISPOT技术还远远没有现在这么普及,对自动读板仪的需求还不足以支撑起一个商业化的产品。四、 ELISPOT的应用与展望ELISPOT技术的独特优点已经让它在抗原特异性T细胞免疫学研究上独占鳌头。它是当今唯一能够检测到到百万分之一阳性细胞率的检测技术。如此高的灵敏度就连流式细胞技术(细胞内细胞因子染色)和tetramer技术也望尘莫及(Letsch A et. al., 2003)。此外由于淋巴细胞的冻存复苏问题也得到了完美的解决,经过冻存复苏的细胞并不丧失免疫功能(Maecker HT et. al., 2005;Kvarnstrom M et. al., 2004)。这一点对临床试验非常重要,它使科研人员得以并行分析免疫治疗前、后的病人血样。如果试验牵涉全国乃至全球多个临床试验机构,病人血样可冻存、运输到到核心实验室仪器检测。同理,一个实验样品或标准对照品可分装冻存,运输到不同的实验室检测,以资比较。所以,ELISPOT技术的应用在国外已经完全普及。凡是需要进行免疫学检测的地方机会都可以应用该项技术。粗略的划分可以分为以下几类:1、疫苗研究开发ELISPOT检测已经成为评价疫苗细胞免疫反应最有效的指标(Harrop R et. al., 2004)。我们知道,疫苗的保护效果可以分为两部分:体液免疫保护和细胞免疫保护。有效的疫苗不仅能够激发强烈的体液免疫,也能激发有效的细胞免疫(Holmgren J et. al., 1992b)。对于某些持续性感染的疾病,疫苗的细胞免疫保护效果甚至居于主要地位。最著名的例子是艾滋病疫苗开发(Lee FK et. al., 1989;Stratov I et. al., 2004)。由于艾滋病毒的超级突变能力,体液免疫往往会被病毒轻易逃避,体内真正控制病毒复制的因素是细胞免疫反应,即清除受感染的CD4+细胞(Vahlne A et. al., 1991;Maecker HT et. al., 2003)。除了预防性的疫苗开发之外,治疗性疫苗也是目前疫苗开发的重要组成部分。治疗疫苗的主要功能在于重新激发起人体内被抑制的针对病源细胞免疫反应。目前的治疗仪表包括乙肝疫苗、黑色素瘤疫苗(Zarour HM et. al., 2003)、肝癌疫苗(Chi KH et. al., 2005)、自身免疫疫苗等等。2、临床指导许多疾病的发生、发展都是与人体的免疫系统异常相关联的。比如各种自身免疫疾病:I-型糖尿病(Karlsson Faresjo MG et. al., 2005),多发硬化症(Moldovan IR et. al., 2005)、系统性红斑狼疮(Kalsi JK et. al., 2004)、牛皮癣/银屑病(Sigmundsdottir H t. al., 1997)、结核病(Restrepo BI 2004)、自身免疫性心肌炎(Maier R et. al., 2005)、自身免疫性感音性耳聋(Solares CA et. al., 2005)、风湿性关节炎(Klatt T et. al., 2005)、.视神经脊髓炎(Correale J et. al., 2004)等等。在这些疾病的诊断、病因查找中,ELISPOT检测可以提供非常重要的信息,甚至成为最终指标。比如在I-型糖尿病的诊断中,ELISPOT可以提供最终的判定依据(Meierhoff G et. al., 2002)。而对有糖尿病史的家族,做ELISPOT检测,甚至可以在疾病发作之前5-10年作出预测(Karlsson Faresjo MG et. al., 2005;Seissler J et. al., 2001)。这对于指导病人的日常生活,提高治疗效果有着重要的现实意义。ELISPOT除了直接用于临床诊断,还可以对于治疗和用药提供重要的参考信息。比如对于器官移植者,用ELISPOT监视患者体内的免疫排斥反应,可以有针对性的用药,避免盲目的使用免疫抑制剂(Tung TH et. al., 2005)。这对于增加移植手术的成功率,延长移植器官的存活率,提高病人的生活质量意义重大(van Besouw NM et. al., 2005;Tambur AR et. al., 2005)。类似的ELISPOT免疫监视也见于基因治疗的病人(Whiteside TL et. al., 2003)。再比如对于乙肝病人,如果用ELISPOT检测观者所处的免疫阶段(急性期、平稳期、耐受期、恢复期),有针对的用药,同时评估各种药物对于观者的治疗效果,远优于盲目治疗(Fan ZP et. al., 2004;Lohr HF et. al., 1998)。3、基础研究ELISPOT技术本来就是在基础研究中创立和发展起来的。生物学和医学的基础研究日新月异,ELISPOT有不可磨灭的功勋。但也正是由于基础研究的发展快,ELISPOT的应用广,所以才难于分门别类。客观地说,在一切免疫学研究的前沿领域,ELISPOT都是最有力的研究工具之一。比如研究人体的免疫系统功能,研究Th0/Th1/Th2细胞转换分析(Ott PA et. al., 2005),研究机体的过敏机制(Bordignon V et. al., 2005;Chapoval SP et. al., 2002),研究癌症的免疫机制(Andersen MH et. al., 2005;Alix-Panabieres C et. al., 2005),研究和筛选有效的T细胞表位肽(Anthony DD et. al., 2003)等等等等,可谓名目繁多,不一而足。ELISPOT技术在基础研究方面所受的限制不在于技术本身,而在于我们的想象能力与创新思维。展望未来的ELISPOT技术,会在技术进步本身和应用领域扩展两个方面都有长足的发展。就技术本身来说,更好的底板材料,无血清检测技术,双因子检测,多因子荧光检测,都会逐渐成熟起来。ELISPOT应用领域的拓展可以从每年发表文献的数量变化上反映出来。图显示了美国国立卫生院生物信息中心论文数据库(NCBI PubMed)收录的自ELISPOT创立以来年度论文的数目。该图反映了ELISPOT技术经历起起伏伏,终于发扬光大,成为免疫学主流检测技术的历程。
|  /3
/3 