前面已经研究了获批的5个大Panel产品,这篇文章写一下国内已获批的多基因小Panel试剂盒。 至于哪些Panel已经获批,基因江湖已经总结的很好了,引用一下:

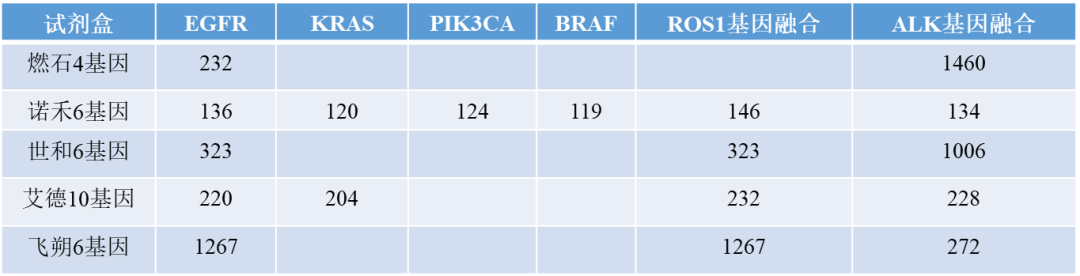
只关注多基因小Panel的话(不包括世和基因的大Panel TMB试剂盒),已有18个相关产品获批。 汇总了一下18个多基因小Panel试剂盒的目标基因检测表: 
汇总一下大概有如下几点: 哪家获批最多? 燃石医学的两个试剂盒,9基因版本完全囊括了4基因版本,相当于产品进行了升级扩容,9基因试剂盒是唯二覆盖RET基因的试剂盒;艾德生物两个试剂盒一个10基因,一个2基因,基因完全不重叠,是独立的两个产品:10基因试剂盒是目前获批基因最多的NGS小Panel试剂盒,2基因BRCA1/BRCA2试剂盒应是唯一获批主要针对卵巢癌、乳腺癌的NGS小Panel产品,含金量最足。
覆盖最多的基因是EGFR, BRAF, KRAS以及检测基因融合的ALK和ROS1,明显绝大部分试剂盒是主要针对非小细胞肺癌的。
所有的试剂盒都是基于组织FFPE样本,还未有基于cfDNA血浆样本的多基因小Panel获批;
测序方式有以下三种: 基于可逆末端终止测序法的Illumina测序平台的试剂盒有13个,占了绝大多数,并且2021年及以后获批的试剂盒都是基于Illumina测序平台的;基于Thermo fisher的半导体测序平台(经达安基因引进国内,在国内研发、生产的DA8600测序仪)的试剂盒有3个;基于华大基因联合锚定测序平台的试剂盒只有2个,华大自己的3基因试剂盒和吉因加3基因试剂盒(两个试剂盒覆盖基因完全一致)。
搞了大半天,最后大部分利润还是进了老美Illumina的腰包。。 除了华大投资过的吉因加,国内同僚为啥不多支持一下华大呢? 不过换平台的确不容易,测序仪和配套的建库试剂自不必说,就是生信流程都需要修改,比如前面说过的测序仪的背景基线,需要重新建吧,还需要重新做产品性能验证,都是钱。。。没办法,这就是先入为主的优势。 经确认,的确只公开了5个,NMPA所有公开的审评报告的链接: https://www.cmde.org.cn/xwdt/shpbg/index.html 从2017年11月公开第一个审评报告,迄今为止,一共21页413个获批医疗器械公开了审评报告,全部翻一遍,还是花不了多长时间的:

看来并不是所有获批医疗器械的审评报告都会公开,详细的公开标准没有查到,只找到了下面的审评报告的流程图,审评中心只会对创新,优先,同品种首个产品的审评报告进行公开。

倒是省了不少时间,全部18个审评报告分析到猴年马月。。。 回归正题,已公开的5个试剂盒的信息如下:

此表汇总几点如下: 公开的审评报告的试剂盒都是2020年及以前获批的,2021年及以后获批的9个小Panel试剂盒审评报告都没公开;
除了艾德生物的10基因试剂盒获批针对非小细胞肺癌和结直肠癌,其他4个都只获批针对非小细胞肺癌;
燃石4基因,世和6基因,艾德10基因都是探针捕获,且都是都是基于Illumina测序平台(NextSeq CN500是贝瑞和Illumina合作研发的,原理相同),诺禾6基因和飞朔6基因则是多重PCR扩增子捕获,使用基于Thermo fisher的半导体测序平台(达安基因引入国内,测序仪为DA8600)。
吐槽一下:华大3基因的试剂盒审评报告不公开一下么。。毕竟新的测序平台。艾德生物的BRCA1和BRCA2试剂盒也不公开一下么。。算是同类产品第一吧。审评中心公开的逻辑。。。 继续往下,5个试剂盒审评报告中的检测限等信息:

此表汇总几点如下: 诺禾6基因和飞朔6基因试剂盒都是基于半导体测序平台,这两个产品同时检测了DNA和RNA,DNA用于突变检测,RNA用于基因融合检测。
DNA和RNA检测基因融合的对比估计大家都知道:基因融合断点大多位于冗长且含有大量重复序列的内含子区域,即使探针捕获,覆盖这些区域都是比较费劲的。相比DNA水平,RNA水平上融合基因表现为前后两个基因外显子之间的衔接,融合断点相对固定,因此RNA水平检测融合基因是更为高效和精准的。
诺禾6基因和飞朔6基因试剂盒使用扩增子捕获,扩增子捕获需要的建库DNA投入量比探针捕获要低很多,10ng足以,突变检测限可达到5%左右,而基于探针捕获的另外三个试剂盒需要的DNA投入量更多,30ng以上,突变检测限可以达到1%左右。
扩增子的两个试剂盒检测限LOD低一些,虽然组织样本一般肿瘤占比较高,但是也有比较低的,再考虑到肿瘤的异质性,所以LOD还是能达到1%为好。
扩增子捕获的这两个试剂盒测序深度要高于探针捕获,一般探针捕获测序深度需500x+,扩增子的这两个试剂盒原始深度都在2000x以上了。
众所周知,扩增子捕获的均一性很一般,不同扩增子之间深度相差很大,为了照顾扩增差的引物,的确需要整体深度更高一些,另外投入量低,第一步就PCR扩增,序列的重复率肯定更高。说到这,为何这两个扩增子试剂盒单独使用RNA检测基因融合,也可理解了,外显子区域长度一般200bp左右,设计引物一般手到擒来,然而冗长且含有大量重复序列的内含子区域设计引物的难度可想而知。现在看来这两个扩增子试剂盒是不得不使用RNA检测基因融合了,也算是转化为了优点,不过既检测DNA又检测RNA,成本肯定会更高。肿瘤FFPE样本肿瘤占比大都建议20%以上,这点老生常谈了,检测肿瘤组织的产品几乎都有这点。
阳性判断值样本数目是确定基因突变和基因融合检测阈值时使用的样本数目;阳性判断值验证样本数目是对已确定的阈值进行初步的验证样本数目;
最重要的多中心临床样本验证,都纳入了至少3个不同的医院,临床样本数目都在1000个以上。
另外需要注意的是,多中心临床验证时,同一样本必须同时进行目标注册试剂盒的检测和一代Sanger测序或者已获批产品的平行检测,两者检测结果需要进行一致性对比。
不仅需要收集足够的样本,还需要对比已获批产品或者一代Sanger测序的结果,相当不容易吧。
接下来,下表是试剂盒与已上市qPCR伴随诊断产品的比较研究数据:
这部分主要是和已上市的基于qPCR平台的伴随诊断产品对比,不过此步有些样本和上表那些临床样本是重复使用的。 最后,TKI药物疗效相关的回顾性临床研究,5个试剂盒验证的对应靶点和靶向药的临床样本数目见下表: 
有了这部分才算是真正的伴随诊断试剂盒,但这部分其实就是“开卷考试”,具体哪个靶点指导哪一种TKI药物,都早已是业内共识。 但最关键是你要去医院收集临床样本,进行这个“开卷考试”。这部分需要的样本数目不算多,10多个,20多个左右能进行统计检验并达到显著即可,不过临床患者的入组,买靶向药,跟踪随访收集患者数据也不容易。 最后试剂盒获批的用途也是根据这部分来定的,上表标黄表示该试剂盒对应的目标靶向药获批,比如: 燃石4基因试剂盒,进行了5个靶向药的验证,但盐酸厄洛替尼(特罗凯)有效样本数目不足,未能达到统计学要求,最后获批的伴随靶向药是4个,另外还需列出未经伴随诊断用途验证的基因位点:


盐酸厄洛替尼(特罗凯)这几个试剂盒有效样本数目竟然都未达标。。 其它试剂盒的就不一一列举了,详细的可阅读审评报告原文。 最后5个试剂盒审评报告都在获批用途最后一段注明了:

NMPA既严格又严谨!!!拿个证多不容易吧!!! 另外汇总了生信流程中突变和融合检测的工具包:

基于探针捕获的上表这三个试剂盒都使用VarScan进行突变calling,基因融合的工具包就各有所爱了。
基于扩增子测序的另外两个试剂盒都是用DA8600测序仪自带的流程包:

|  /3
/3 