
汇聚全球精英,分享科研成果,洞察行业前沿。6月25日上午,备受瞩目的第五届国际兽医检测诊断大会(AVDC)在杭州国际博览中心隆重开幕!大会由美国堪萨斯州立大学、国际动物卫生合作伙伴、正大集团、美国明尼苏达大学、美国乔治亚大学、美国爱荷华州立大学、中国农业大学、南京农业大学的多位知名专家发起,本届大会由国际兽医检测诊断大会、中国农业大学、南京农业大学动物医学院以及世信朗普国际展览(北京)有限公司联合主办,深圳市专家人才联合会实验病理学专业委员会、中国医学装备协会病理装备分会、实验病理学公益网络学习会平台、四川农业大学、农宜科科技(郑州)有限公司协办,北京世信兴化国际咨询有限公司承办。

本届大会继续秉承“强有力的兽医诊断,以提高动物健康与食品安全”的宗旨,邀请中国、美国、英国、荷兰、加拿大、澳大利亚、日本、韩国等国家的120位嘉宾,将为参会代表带来128场精彩纷呈、内容丰富的主题报告,与广大参会代表分享自己在兽医诊断领域的独到见解和宝贵经验。本届大会参会代表人数达到1660位。
大会得到了正大集团、金诺诊断、标允奥睿特、亿森宝、悦洋生物、诺唯赞、金泉医疗、徕卡、华大智造、森康、Oxford Nanopore、迪谱诊断等行业知名企业的赞助支持。

上午8时30分,第五届国际兽医检测诊断大会开幕式隆重举行。美国明尼苏达大学刘爱民博士主持开幕式并介绍大会内容,南京农业大学动物医学院副院长平继辉,中国农业大学动物医学院副院长韩军,中国兽医协会兽医实验室检测分会副会长陈西钊分别致辞,全球动物健康合作伙伴有限公司理查德·弗兰奇博士作大会介绍。

图 刘爱民主持开幕式
美国明尼苏达大学刘爱民博士表示,作为目前亚洲最大的兽医检测诊断领域的专业会议,它通过分享前沿科研成果与实用技术,有力提升了兽医诊断实验室的检测实力,推动了兽医检测诊断技术的创新,同时大会也为食品动物养殖者提供国际水准的兽医专业指导,在培养兽医诊断人才方面也功不可没。刘爱民博士还指出,本届大会创新性地增设了水产动物诊断会前研讨会和实验病理分会,进一步拓宽了学术交流与合作的领域。

图 理查德·弗兰奇作大会介绍
全球动物健康合作伙伴有限公司理查德·弗兰奇博士在大会介绍中回顾了AVDC的发展历程,介绍了本届AVDC的组委会成员,对他们辛苦付出和卓越贡献表示了崇高的敬意。他还介绍了大会的合作机构,并对他们为大会提供的支持表示了深深的感谢。
图 平继辉致辞
南京农业大学动物医学院副院长平继辉在致辞中介绍了学院在兽医检测诊断领域的显著进展和研究成果,这些成果为行业的发展提供了有力支撑。他表示,AVDC在兽医事业快速发展的背景下应运而生,作为兽医诊断领域最具规格的盛会,AVDC不仅为行业带来了前沿的知识、先进的理念和尖端的技术,更促进了科研成果的广泛推广与实际应用,从而不断推动了兽医诊断事业迈向新高度、取得新辉煌。
中国农业大学动物医学院副院长韩军在致辞中表示,畜牧业是农业农村经济发展的重要支柱,动物疫病防控是畜牧业发展的关键,要实现有效的疫病防控,必须注重“三早”原则——早发现、早预警、早应对。他表示,AVDC的举办为高校、企业及同行等提供了重要的知识交流与传播分享的平台,提供了思想的交流碰撞平台,也提供了产学研融合、产业链和价值链融合的平台,他期待高校、科研院所与企业能够找到更多的契合点,携手合作,共同推动行业的持续进步与健康发展。
中国兽医协会兽医实验室检测分会副会长陈西钊在致辞中向大会的召开表示热烈祝贺,对国内外的专家学者到来表示热烈欢迎。他说,AVDC成为兽医诊断领域研发、生产、应用等各个环节从业人员的盛会。在这个平台上,大家能够深入交流,及时了解病原的最新演化、掌握最前沿的诊断技术、探索最实用的解决方案,这对于未来动物疫病的防控具有至关重要的意义。他希望参会代表能够开展更广泛深入的交流,学习最先进的技术,掌握最前沿的科技,为中国动物疫病的防控工作做出全行业的贡献。

大会开幕式后举办了主论坛,美国爱荷华州立大学张建强博士、中国农业大学动物医学院副院长韩军教授分别聚焦蓝耳病毒的诊断和防控、PRRSV类NADC30毒株的分子基础进行了主题演讲,美国爱荷华州立大学德鲁·马格施塔特、加拿大萨斯喀彻温大学马修斯-科斯塔、日本藤田医科大学高桥雅英三位专家,分别就高致病性禽流感A型(H5N1)2.3.4.4b群病毒感染奶牛、马链球菌动物流行亚种、病理技术的发展及其在检测和诊断中的应用等热议话题进行了学术分享。主论坛后,大会还将围绕分子学诊断、病毒/血清学、微生物诊断、实验病理、兽医病理、毒性病理、实验室安全和质量保证、兽医诊断领域的新技术、流行病学和诊断数据分析中的人工智能应用等举办14场分会。

同期举办的亚洲兽医器械及药品展览会,进入第二天,展会集结了兽医器械、药品及检测诊断领域的尖端产品、前沿技术与创新突破,吸引了众多高质量的专业观众前来参展交流。现场人流涌动,观众络绎不绝,咨询洽谈的氛围极为热烈。本届展会展示面积1万平方米,参展企业达到171家。
与会的各界人士对本届大会充满信心和期待。他们相信,通过深入交流与探讨,一定能够激发出更多的创新思维和解决方案,也期待在未来的合作中能够取得更加丰硕的成果,共同为全球动物健康和食品安全保驾护航。
2024年6月25日上午,第五届国际兽医检测诊断大会暨亚洲兽医器械及药品展览会在杭州国际博览中心召开,大会开幕及主题演讲,主持人为美国明尼苏达大学刘爱民博士。
图 刘爱民博士正在主持
主持人:刘爱民
上午-大会开幕及主题演讲
8:30am 开幕式
9:00am 主题演讲1 – 蓝耳病毒的诊断、流行病学、预防和控制概述, 张建强,美国爱荷华州立大学
9:40am 主题演讲2 – PRRSV类NADC30毒株上升为优势毒株的分子基础,韩军,中国农业大学
10:35am 热议话题1 –高致病性禽流感A型(H5N1)2.3.4.4b群病毒感染奶牛,德鲁·马格施塔特,美国爱荷华州立大学
11:05am 热议话题2 – 马链球菌动物流行亚种,马修斯·科斯塔,加拿大萨斯喀彻温大学
11:35am 热议话题3 – 病理技术的发展及其在检测和诊断中的应用,高桥雅英,藤田医科大学,日本

图 张建强,美国爱荷华州立大学
一、多年来提交用于PRRSV PCR检测的样本类型的动态变化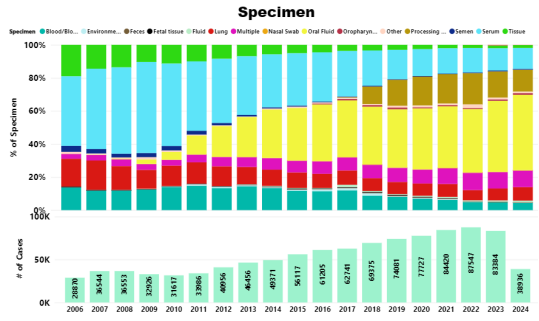
| 样品 | 适合猪的年龄 |
| 肺脏 | 任何日龄 |
| 淋巴组织 | 任何日龄 |
| 血清 | 任何日龄 |
| 处理液(睾丸液/尾液) | 小猪(约2-7天大) |
| 家族口腔液 | 断奶前(例如18-21日龄) |
| 舌尖液 | 猪场死胎,死猪 |
| 常规口腔液 | 断奶到育成 |
三、临床样本和细胞培养分离物中的PRRSV是否相同?基于1024份PRRSV PCR阳性临床样本及其在MARC-145和ZMAC细胞中的分离株的评估。在大多数情况下(98.6%),来自临床样本及其细胞培养分离株(MARC-145或ZMAC)的PRRSV ORF5序列相互匹配。一小部分病例(例如14/995 PRRSV-2病例,1.4%)在临床样本和MARC-145分离株之间具有不匹配的病毒序列,尽管来自临床样本和ZMAC分离株的病毒序列匹配。基于额外检测(疫苗特异性PCR和NGS)的临床样本中是否存在PRRSV混合感染(≥2株PRRSV-2株)。在使用分离株生产自体疫苗或其他应用之前,应确定临床样本和细胞培养分离株的PRRSV序列。四、用于检测和表征PRRSV的分子工具
五、基于PRRSV-2 ORF5和PRRSV-1 ORF5的分类


1995年中国大陆首次报道PRRS,1996年分离到该病毒(CH-1a株),被认为是中国的经典毒株。L8E1997年在中国大陆报道了VR2332样PRRSV(Ingelvac PRRS MLV疫苗的亲本株)(BJ-4株),被认为是中国的经典毒株。L5A2006年我国大陆地区出现高致病性PRRSV(HP-PRRSV)(JXA1株、HuN4株、TJ株),来源于CH-1a样毒株。L8E2011年FJ-1株是2005年在中国大陆发现的第一株L3型PRRSV,但2010年发现的QYYZ样L3株逐渐在中国大陆流行。L32013年在中国大陆分离的NADC30样PRRSV。L1C2017年在中国大陆分离的NADC34样PRRSV。L1APRRSV-2 L3毒株最初在台湾报告,后来在香港报告,然后在中国大陆检测中国的PRRSV-2 L5A、L1C和L1A似乎主要是由于北美谱系的引入,然后是局部多样化(包括重组),导至新的疾病爆发和毒力增加基于ORF5的PRRSV-2和PRRSV-1基因分类例如,通过跟踪新病毒的引入和/或病毒的传播/进化来检查农场的生物安全和生物防护的有效性无法可靠地预测病毒的表型特征(如毒力),但属于同一“变体”的病毒更有可能彼此相似不能反映ORF5以外基因组区域的遗传变异。全基因组序列更适合用于此目的,包括用于重组分析网站https://fieldepi.research.cvm.iastate.edu/domestic-swine-disease-monitoring-program/ 该项目的目标是以直观的格式(网络仪表盘和PDF月度报告)汇总猪的诊断数据和报告,描述基于PCR的分析在一段时间、样本、年龄组和地理区域内的病原体检测动态。数据来自爱荷华州立大学VDL、南达科他州立大学ADRDL、明尼苏达大学VDL,堪萨斯州立大学VDD、俄亥俄州动物疾病诊断实验室和普渡大学ADDL。PRRSV ORF5 RFLP和谱系仪表板,数据来自ISU、UMN、KSU、俄亥俄州和普渡VDL。PDF报告每月生成一次,但网络界面是实时的,数据每天更新SDRS数据不能准确估计美国猪病原体的发病率和流行率,但可以显著反映病原体的状况生物安全、生物防护和管理
降低将PRRSV引入阴性畜群或将新的PRRSV变体引入阳性畜群的可能性检疫设施的使用和对外来种畜的检测流程,例如后备培育舍(GDU)通过猪流量策略进行管理,例如,在某些畜群中进行全面管理局部消除方法:减少种群/重新种群、部分减少种群、测试和移除、群体封闭诱导保护性免疫(全球视角)
活病毒接种(LVI):农场特异性野生型病毒,例如感染猪的血清Porcilis PRRS (MSD Animal Health); Suvaxyn PRRS MLV (Zoetis); Unistrain PRRS (HIPRA), Pyrsvac-183 (Syva Laboratories); Ingelvac PRRSFLEX and ReproCyc PRRS EU (Boehringer Ingelheim)Ingelvac PRRS MLV (Boehringer Ingelheim) in 1994: L5AIngelvac PRRS ATP (Boehringer Ingelheim) in 1997: L8AFostera PRRS (Zoetis) in 2012: L8CPrime Pac PRRS RR (Merck) relaunched in 2018: L7Prevacent PRRS (Elanco) in 2018: L1DPRRSGard (Pharmgate Animal Health) in 2020: L1FNumerous MLV vaccines in Asia商业PRRSV MLV疫苗可能对遗传多样的PRRSV分离株具有不同的保护效力定期检测替代母猪,以避免将感染PRRSV的母猪引入繁殖群。如果将阳性母猪带到猪群中,避免引入感染了农场特有的独特野生型PRRSV毒株的母猪。避免在同一畜棚内混合感染不同PRRSV(如野生型或疫苗)的猪如果使用活病毒接种物(LVI)材料免疫猪,则通过NGS测试LVI材料,以调查样本中的病毒身份,并避免将LVI与多种PRRSV毒株一起使用。不要轮换PRRSV MLV疫苗,即在替换母猪、繁殖群和下游流中保持一致的疫苗接种计划。如果需要轮换,在开始新的MLV之前,等待当前疫苗的病毒血症下降。不建议使用与繁殖群中使用的MLV不同的MLV对断奶仔猪进行免疫接种。如果需要,当猪从繁殖群转移到场外设施时进行。不要在同一动物或猪群中使用两种或两种以上的MLV疫苗。在急性疫情期间,使用抗炎药控制发烧,使用抗生素控制继发细菌感染抗PRRSV感染的转基因猪和/或对PRRSV病毒感染具有天然恢复力的猪Sus scrofa 4号染色体包含一个用于宿主对PRRSV感染反应的定量性状位点(QTL)。QTL中的一个区域被单核苷酸多态性(SNP)WUR10000125标记。在猪中,该QTL区域包含5个鸟苷酸结合蛋白(GBP)基因。尽管PRRSV感染,GBP5基因突变可能与生长参数增强有关。
PRRSV类NADC30毒株上升为优势毒株的分子基础

图 韩军,中国农业大学
挑战3: PRRSV变异影响疫苗交叉保护的分子机制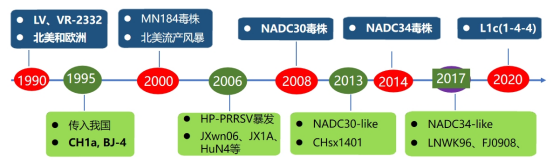

二、NADC30和NADC34毒株上升为优势毒株

附2008 年在美国首次分离出的 NADC30 毒株2013年左右传入我国(NADC30-like毒株)2016年以来,NADC30-like及其重组毒成为我国主要的流行毒株以母猪流产等繁殖障碍为特征,发病母猪群的流产率可达达30%-40%哺乳仔猪和保育猪和生长育肥猪以呼吸道疾病为主,猪细菌性继发感染和死淘率增高我国NADC30-like毒株复杂,实验室条件下对仔猪一般表现为中低致病力,无致死性HBap4-2018,HP-PRRSV (骨架)与NADC30-like重组,致病性位于HP-PRRSV和NADC30-like之间四、NADC34-like 起源
与NADC30-like同属于谱系L1,但NADC34属于1.52014年,在美国首次报道PRRSV 1-7-4 (NADC34) 在美国NADC34-like毒株之间同源性差异较大,对仔猪的致病性存在差异原型毒株IA/2014/NADC34对仔猪表现为较高致病性4个国家报道NADC34-like的流行:美国(2014),秘鲁(2015),韩国(2017)2017年,在我国辽宁分离到NADC34-like毒株,逐渐传播到我国20多个省份,成为部分省份的优势毒株大部分对仔猪仅表现为轻度(eg:HLJDZD32-1901)或中度(ZDXYL-China-2018-1)致病性; 在妊娠母猪中的致病性尚不明确,但可以引起母猪的流产2022年8月31日,报道一例高致病性毒株JS2021NADC34 PRRSV
五、Nsp2介绍
PRRSV nsp2: 一个神秘的多功能复制酶蛋白遗传变异:PRRSV 基因组中变异最大和最快的区域天然免疫:PLP2具有去泛素化酶活性,拮抗天然免疫复制酶蛋白nsp2是PRRSV遗传变异最快和最大的区域六、Nsp2变异对PRRSV复制和致病性的影响
PRRSV nsp2 遗传变异病毒毒力和持续性感染谱系8 HP-PRRSV nsp2是毒力因子,具有很强激活炎症及免疫系统的能力,是诱导机体产生持续性高热和炎症反应的关键蛋白,TLR4、IL-1β和MPO为其调节免疫反应的核心基因 类NADC30毒株结构蛋白(SP)免疫原性差, 诱导抗体水平低,类NADC30毒株CHsx1401是一个sneaky病毒,具有很强的免疫逃逸能力, 不能有效激活炎症和宿主免疫系统,从而促进了病毒的持续性感染 为阐释类NADC30毒株上升为优势毒株PRRSV提供了科学依据 七、我国NADC30-like毒株重组特性总结
L1重组主要集中在L1.8(NADC30-like)和L8(HP-PRRSV/HP-PRRSV 疫苗)间的重组NADC30-like毒株参与的重组毒的nsp2大多数来自于NADC30-like作为亲本毒时:重组热点在nsp9,GP2和GP3, 重组病毒保留了 NADC30-like nsp2作为供体时:nsp2和结构蛋白重要重组热点,重组病毒获得NADC30-like nsp2 或结构蛋白(SP)2020年后,L1.5 (NADC34-like)开始与本土毒株开始重组,增加了重组复杂性
八、从nsp2 角度审视PRRSV毒株重组特征
HP-PRRSV nsp2促进病毒清除,降低病理损伤,协同结构蛋白提高对同源毒株的免疫保护力
九、总结
遗传变异的分子基础(免疫抑制与逃逸、抗原性改变等),为阐释类NADC30毒株上升为优势毒株PRRSV提供了科学依据;刚者易折,柔则长存;以天下之至柔,驰骋天下之至坚。
高致病性禽流感A型(H5N1)2·3·4·4b群病毒感染奶牛

图 德鲁·马格施塔特,美国爱荷华州
有类似临床症状的其他受影响奶牛场(约15-20个地点)3月14日至15日:与受影响农场的兽医举行电话会议还注意到死亡鸟类(3月11日:在该地区的野生鸟类中检测到H5N1)3月21日:收到了来自受临床影响的奶牛和两只死亡猫的8份样本二、开发我们的诊断工具
初步结果→对已知状态的样本具有良好的敏感性和特异性诊断测试结果显示为5天滚动平均值→当天之前2天到之后2天的所有样本四、当前知识:我们认为我们知道的
我们能/如何最好地检测非哺乳期动物(奶牛、怀孕的小母牛、小牛)的急性感染?什么样的样本类型最适合病毒检测?感染时机是否起作用?

图 马修斯·科斯塔,加拿大萨斯喀彻温大学
一、马链球菌亚种,兽疫
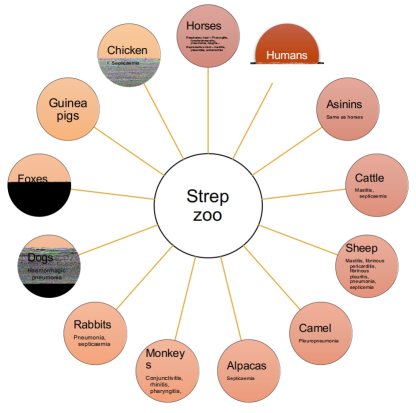
二、2019年前,兽疫马链球菌亚种和猪
1977-主要爆发>300000猪死亡(冯和胡,1977)1978-1990-2000年代零星病例显著影响行业(毛等.,2008)任何年龄对抗菌素敏感的年龄(一段时间内自体/细菌疫苗)三、兽疫马链球菌亚种的诊断

四、兽疫马链球菌亚种和猪的案例
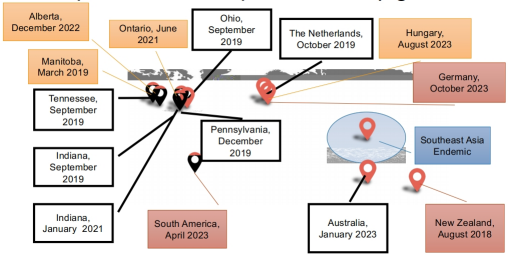
五、兽疫马链球菌亚种和非洲猪瘟的比较
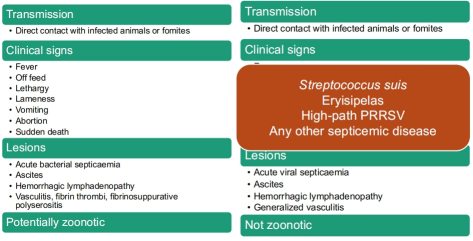
兽疫马链球菌亚种正在“出现”,但它可能一直存在,临床看起来像猪ASF和猪/PRRSV实验室无法检测动兽疫马链球菌亚种,可能报告为链球菌,甚至猪链球菌

图 高桥雅英,藤田医科大学,日本
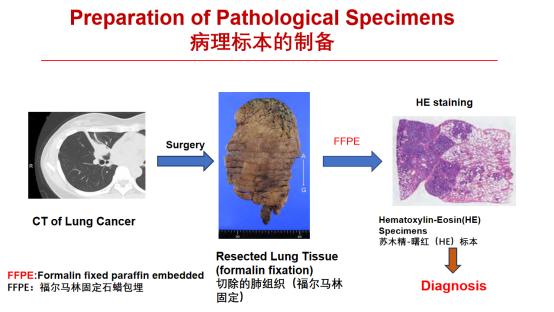
一、病理标本的制备
二、免疫组织化学的病理诊断及其在癌症治疗中的应用
免疫组织化学诊断-1:HE染色诊断为低分化癌的肺癌2例免疫组织化学诊断-2:根据雌激素受体(ER)、孕酮受体(PgR)和Her2蛋白的表达对癌症(导管腺癌)进行分类。免疫组织化学诊断-3:检查雌激素受体(ER)、孕酮受体(PgR)和Her2蛋白的表达对于选择合适的癌症治疗是必要的
三、使用组织样本通过荧光原位杂交(FISH)检测基因改变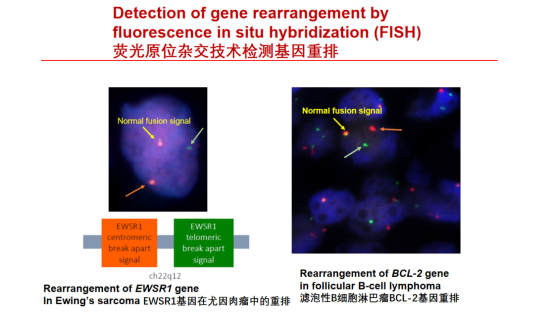
四、使用组织样本的下一代DNA或RNA测序及其在分子靶向治疗中的应用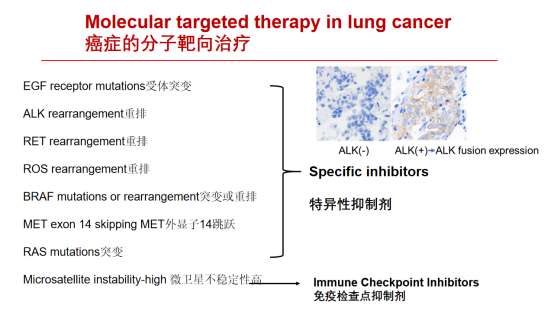
1985年,我们发现RET是一种通过DNA重排激活的癌基因(Takahashi et al. Cell 1985)RET重排于1990年首次在人类癌症、乳头状甲状腺癌症中检测到。2012年在肺腺癌中检测到RET重排。(Grieco et al. Cell 190)使用下一代序列在各种癌症中检测到RET重排,如结肠、乳腺、唾液腺、spizoid肿瘤等。(Kato et al. Clin Cancer Res. 2017; Paratala et al. Nat. Commun. 2018 )客观有效率(ORR):治疗幼稚和铂类化疗预处理患者分别为85%和64%客观有效率(ORR):治疗幼稚和铂类化疗预处理患者分别为70%和61%
数字病理促进了远程诊断网络,使病理学家能够远距离分析和诊断医疗状况。这在获得专业医疗专业人员的机会有限或及时诊断至关重要的情况下尤其有用。远程工作,特别是以远程病理学的形式,允许病理学家在家工作,同时对组织样本进行诊断评估。基于家庭的远程病理学可以提高效率,减少诊断的周转时间,并为病理学家提供灵活性,尤其是在现场工作可能具有挑战性或不可用的情况下。 2.免疫组化病理诊断及其在癌症治疗中的应用(1960~) 3.使用组织标本通过荧光原位杂交(FISH)检测基因改变(1980~) 4.使用组织标本的下一代DNA或RNA测序(2000s~)大会官网:www.avdc-china.com
邮箱:avdcchina@163.com
 /3
/3 