众所周知,中国是肝癌大国。据2018年发布的《中国肝癌大数据报告》显示,原发性肝癌全球每年新发病例85.4万,中国46.6万,约占全球的55%,这意味着,全球新发肝癌一半在中国。但针对肝癌的治疗效果并不乐观,一旦癌细胞扩散,肝癌患者活下去的希望几乎为零。
为了改变这一惨痛的现状,也为了挽救更多的肝癌患者,我国科学家一直在肝癌的精准治疗上不断努力着。今年国庆期间,我国科学家们便以两项肝癌研究的最新成果献礼祖国70岁生日,也为我国无数肝癌患者带来生的希望。
Nature:“组合拳疗法”诱导癌细胞衰老再消灭

DOI:https://doi.org/10.1038/s41586-019-1607-3
10月2日,国际重磅杂志《Nature》在线发表了由上海交通大学医学院附属仁济医院上海市肿瘤研究所覃文新课题组与荷兰癌症研究所Leila Akkari课题组、René Bernards课题组合作的最新研究成果。
该研究关注:长期以来,“杀敌一千,自损八百”的抗肿瘤化疗药物大多是针对细胞增殖特点而研发的,在杀死肿瘤细胞的同时也会杀死人体内增殖更新的正常组织细胞,这一疗法并非是有效延长肿瘤患者生存期的最佳选择。那么,是否存在一种疗法,在精准消灭肿瘤细胞的同时却不影响正常细胞增殖呢?
于是,该研究团队创新性地提出了“One-two punch(组合拳式)”肝癌治疗模式,开启了“诱导和利用肿瘤细胞弱点治疗肝癌”的全新研究。
虚招:诱导突变细胞“衰老”,暴露弱点
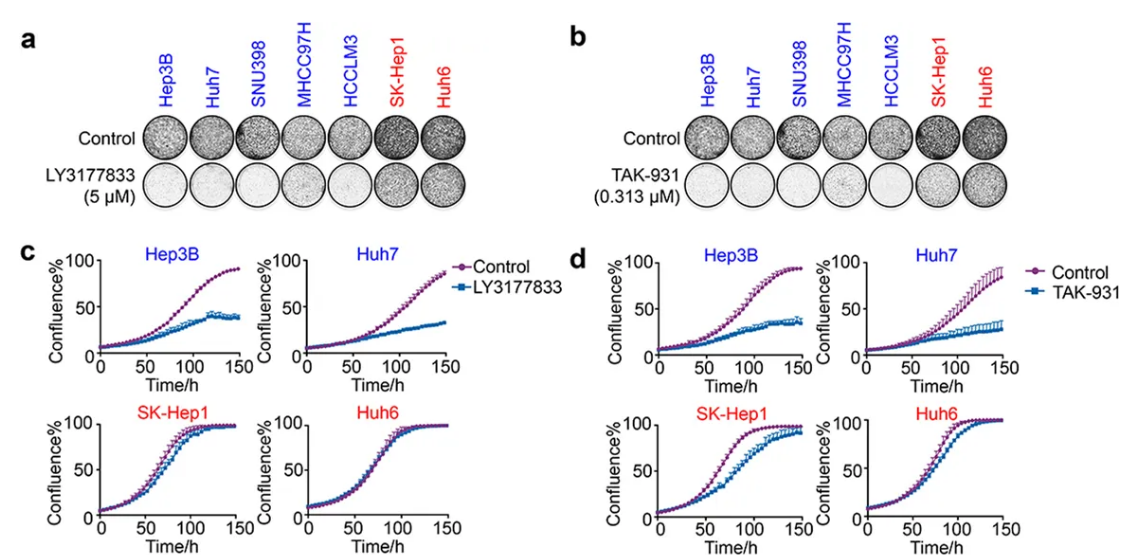
首先,研究人员通过CRISPR-Cas9基因编辑技术,在肝癌细胞中找到了38个对癌细胞增殖有关键作用的基因。接着使用高通量化合物筛选技术,首次发现了细胞分裂周期激酶(CDC7)抑制剂能特异地诱导TP53突变肝癌细胞衰老,而对TP53野生型肝癌细胞和正常细胞无衰老诱导作用。目前,在肝癌患者中存在35%至40%的TP53突变患者,也就意味着这一研究将为全球超过30万的肝癌患者带来治愈希望。
实招:根据“弱点”进行药物筛选,抑制肝癌进展
在“虚招”成功诱导肝癌细胞特异性发生衰老的基础上,研究人员再次通过高通量化合物筛选技术发现,目前临床治疗抑郁症的药物舍曲林可以特异地促进衰老肝癌细胞凋亡,并且“它可通过下调哺乳动物雷帕霉素靶蛋白(mTOR)信号通路促进衰老肝癌细胞凋亡。”

上海市肿瘤研究所副所长覃文新教授 图片来源:上海市肿瘤研究所
上海市肿瘤研究所副所长覃文新教授表示:目前该研究结果已在肝癌动物模型中得到证实,CDC7抑制剂和mTOR抑制剂联合使用,能显著抑制肝癌进展,其作用显著优于多靶点药物索拉非尼等。此外,CDC7抑制剂和mTOR抑制剂目前均已处于临床试验阶段,有望为肝癌治疗提供新方法。
Cell:全球最大规模全景式肝癌队列多维蛋白组学图谱已“出炉”

DOI:https://doi.org/10.1016/j.cell.2019.08.052
10月3日,国际顶级学术期刊《Cell》在线发表了由中国科学院上海药物研究所周虎课题组与复旦大学附属中山医院樊嘉院士课题组、中国科学院生物化学与细胞生物学研究所高大明课题组合作的最新成果。
该研究团队关注:肝细胞癌(HCC)占所有原发性肝脏恶性肿瘤的85%-90%,其诱发的主要原因在于乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)慢性感染、酗酒以及代谢综合征。尽管最新的基因测序研究已然揭示了HCC的遗传图谱,也揭示了TP53,CTNNB1,TERT启动子和其他关键基因位点中的驱动程序突变。但是,遗传突变如何驱动HBV相关HCC中的癌症表型仍然是未知的。

在本项研究中,研究人员收集了159例乙肝病毒阳性的肝癌和癌旁样本,运用最先进的组学技术测定了外显子组、转录组、全蛋白组、磷酸化蛋白组数据,开展了肝癌多维蛋白组学研究,通过对庞大基因和蛋白数据的大规模集中扫描,绘制出目前全球最大规模的全景式肝癌队列的基因蛋白组学图谱,多维度地揭示从基因突变到转录以及蛋白质翻译的整个过程。完整地揭示了肝癌的分子特性,全面解析了肝癌的发生和发展机制,为肝癌的精准分型与个体化治疗、疗效监测和预后判断提供了新的思路和策略。
让人惊喜地是,该研究还带来了三个最新研究发现:其一,我国肝癌突变谱与西方肝癌突变谱的存在不同之处。
2012年,马兜铃酸被世界卫生组织列为1类致癌物。在该研究中竟然发现35%的肝癌样本中含有马兜铃酸诱导的基因突变“指纹”,且突变“指纹”与肿瘤突变负荷增高、微环境免疫耐受显著相关,提示了免疫治疗对该类肝癌的潜在价值。在通过深入分析染色体拷贝数变异,揭示了染色体4q和16q的缺失会通过反式效应(transeffect)影响细胞周期相关蛋白并促进肝癌的发生发展。
其二,对蛋白质组数据进行统计后可将肝癌患者分为三个亚型,分别为代谢驱动型、微环境失调型和增殖驱动型。
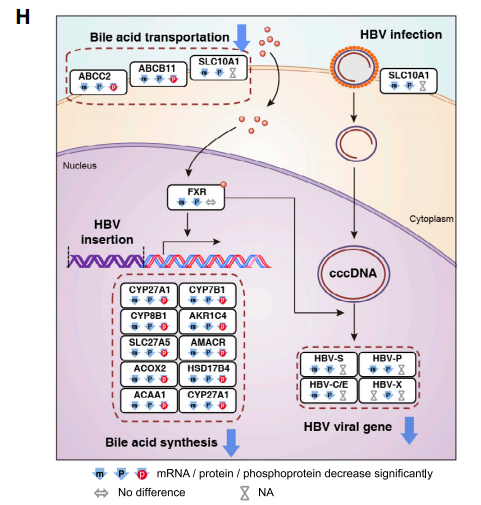
这三个亚型与基因组稳定性、癌栓的有无、甲胎蛋白丰度及RB1和TSC2基因突变等特征显著相关;更重要的是,三个亚型的临床预后显著不同,且其预后价值不依赖于临床上常用的TNM分期,有望为肝癌的个性化精准治疗和临床预后判断提供指导。
其三,系统地揭示了代谢异常在肝癌发生发展中的重要作用。

研究发现超过80%的肝脏特异性基因在肝癌中呈现蛋白表达下调,而且肝特异性代谢途径中的大多数蛋白(如糖异生,解毒和尿素-氨代谢)在肝肿瘤中显著减弱,然而胆固醇代谢的关键酶(SOAT1,SOAT2,HMGCR等)和谷氨酰胺代谢相关蛋白(GLS和GLUD2)在肿瘤中表达显著上调。这些数据表明在HBV相关的肝癌中,靶向调控代谢通路将起到防治或治疗的重要作用。

施巍炜博士 图片来源:至本医疗科技
本文共同第一作者,至本医疗科技的计算肿瘤学部副总裁施巍炜博士表示,“多维组学的优势和意义在于它可以全面地获取肿瘤不同维度的信息,利用组学间的交叉互补,探索彼此之间的内在关联,从很大程度上弥补了单一组学的不足。希望未来和临床更紧密的结合,为每一位癌症病人提供全面、准确的分子水平信息,推动癌症治疗的革新。”
参考资料:
[1] Inducing and exploiting vulnerabilities for the treatment of liver cancer
[2] Integrated Proteogenomic Characterization of HBV-Related Hepatocellular Carcinoma











 /3
/3 





 浙公网安备33010802005999号
浙公网安备33010802005999号


